Интактная межжелудочковая перегородка что это
Интактная межжелудочковая перегородка что это
Частота патологии составляет около 0,06—0,07 на 1000 новорожденных, 1-3% среди всех ВПС, 3-5% среди критических ВПС.
Аномалии коронарных артерий (фистулы, стенозы, перерывы, эктазии) обнаруживают более чем у 45% больных. Наибольшее значение при этом имеют эмбриональные сообщения между коронарными артериями и синусоидами правого желудочка, приводящие к аномальному коронарному кровотоку. Возможно также развитие фиброэластоза эндокарда правого желудочка.
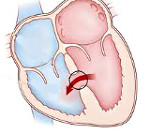
Гемодинамика. Нарушения гемодинамики определяются отсутствием антеградного поступления крови из правого желудочка в легочную артерию при невозможности сброса этой крови через ДМЖП в левые отделы.
При выраженной гипоплазии желудочка его наполнение незначительно, практически вся кровь из правого предсердия шунтируется через открытое овальное окно в левое предсердие. В случаях, когда кровь все же поступает в полость правого желудочка (при незначительной гипоплазии), возникает его объемная перегрузка, так как опорожнение происходит только ретроградно через трикуспидальный клапан и/или сохраненные синусоиды.
Для выживания ребенка необходимо наличие открытого овального окна и альтернативного кровоснабжения легких (через ОАП или коллатерали, отходящие от аорты). При данной патологии кровь через ОАП течет из аорты в легочную артерию уже во внутриутробном периоде (в отличие от нормы, когда поток направлен из легочной артерии в аорту); в этом случае проток приобретает вид тонкого извитого сосуда. После рождения в большинстве случаев также имеется дуктус-зависимое легочное кровообращение. При этом левый желудочек нагнетает кровь в оба круга кровообращения.
При наличии выраженных синусоидов значительная часть крови в коронарное русло поступает из правого желудочка, давление в котором нередко значительно превышает системное. В результате насыщение коронарной крови кислородом снижается и высока вероятность развития гипоксии миокарда.
Фетальная ЭхоКГ. В связи с измененной четырехкамерной проекцией сердца выявляемость порока достаточно высокая — около 30%. Основа диагностики — гипоплазия правого желудочка, которая чаще обнаруживается во второй половине беременности. При изучении выводных трактов желудочков выявляется резко гипоплазированная легочная артерия; кровоток через легочный клапан отсутствует. ОАП имеет вид тонкого извитого сосуда, через который кровь течет из аорты в легочную артерию.
Естественное течение. Внутриутробное развитие плода обычно не претерпевает серьезных изменений. Содержание кислорода в системном и коронарном русле существенно не нарушено, так как не зависит от легочного кровотока. Левый желудочек обеспечивает необходимое кровообращение, заметно преобладая над правым. Родоразрешение рекомендуется в специализированном учреждении, располагающем возможностями для инфузии простагландинов и последующего хирургического лечения. Порок относится к 1-й категории тяжести.
Сразу после рождения с разделением кругов кровообращения возникает массивный сброс венозной крови в БКК, артериальная гипоксемия, правожелудочковая недостаточность.
Точных данных о естественной смертности нет, так как для спасения жизни пациентов рано прибегают к оперативному лечению. Однако и суммарный (естественный + модифицированный операцией) прогноз приданном пороке плохой, несмотря на достижения детской кардиохирургии. В 80-е годы в течение первого месяца умирали 57% больных, к концу первого года жизни — 77%. Спустя 20 лет соответствующая летальность составляет 12 и 52%. Шансы на выживание выше при адекватно функционирующем межпредсердном сообщении и ОАП, а также незначительной гипоплазии правого желудочка. В странах с развитым пренатальным скринингом обнаружение данной патологии обычно сопровождается прерыванием беременности, что приводит к значительному снижению ее частоты в популяции.
Дефект межжелудочковой перегородки
Дефект межжелудочковой перегородки – врожденная внутрисердечная аномалия, характеризующаяся наличием сообщения между правым и левым желудочками. Дефект межжелудочковой перегородки проявляется одышкой, отставанием в физическом развитии, быстрой утомляемостью, учащенным сердцебиением, наличием «сердечного горба». Инструментальная диагностика дефекта межжелудочковой перегородки включает проведение ЭКГ, ЭхоКГ, рентгенографии органов грудной клетки, вентрикулографии, аортографии, катетеризации камер сердца, МРТ. При дефектах межжелудочковой перегородки проводят радикальные (закрытие дефекта) и паллиативные (сужение легочной артерии) вмешательства.
МКБ-10
Общие сведения
Дефект межжелудочковой перегородки (ДМЖП) – отверстие в перегородке, разделяющей полости левого и правого желудочка, наличие которого приводит к патологическому шунтированию крови. В кардиологии дефект межжелудочковой перегородки – наиболее часто встречающийся врожденный порок сердца (9–25% от всех ВПС). Частота критических состояний при дефекте межжелудочковой перегородки составляет около 21%. С одинаковой частотой порок обнаруживается у новорожденных мальчиков и девочек.
Причины дефекта межжелудочковой перегородки
Непосредственными факторами, вызывающими нарушение эмбриогенеза, выступают вредные воздействия на плод в I триместре гестации: заболевания беременной (вирусные инфекции, эндокринные нарушения), алкогольная и лекарственная интоксикации, ионизирующая радиация, патологическое течение беременности (выраженные токсикозы, угроза самопроизвольного прерывания беременности и пр.). Имеются данные о наследственной этиологии дефекта межжелудочковой перегородки. Приобретенные дефекты межжелудочковой перегородки могут являться осложнением инфаркта миокарда.
Особенности гемодинамики при дефекте межжелудочковой перегородки
После рождения и установления кровотока в большом и малом кругах кровообращения из-за дефекта межжелудочковой перегородки возникает лево-правый сброс крови, объем которого зависит от размеров отверстия. При небольшом объеме шунтируемой крови давление в правом желудочке и легочных артериях остается нормальным либо незначительно повышается. Однако при большом поступлении крови через дефект в малый круг кровообращения и ее возврате в левые отделы сердца, развивается объемная и систолическая перегрузка желудочков.
Значительное повышение давления в малом круге кровообращения при больших дефектах межжелудочковой перегородки способствует возникновению легочной гипертензии. Повышение легочно-сосудистого сопротивления взывает развитие сброса крови из правого желудочка в левый (обратного или перекрестного шунтирования), что приводит к артериальной гипоксемии (синдром Эйзенменгера).
Многолетняя практика кардиохиругов показывает, что наилучших результатов закрытия дефекта межжелудочковой перегородки можно добиться при сбросе крови слева направо. Поэтому при планировании операции тщательно учитываются гемодинамические параметры (давление, сопротивление и объем сброса).
Классификация дефекта межжелудочковой перегородки
Размер дефекта межжелудочковой перегородки оценивается, исходя из его абсолютной величины и сопоставления с диаметром аортального отверстия: маленький дефект составляет 1-3 мм (болезнь Толочинова–Роже), средний – равен примерно 1/2 диаметра аортального отверстия, большой – равен или превышает его диаметр.
С учетом анатомического расположения дефекта выделяют:
Симптомы дефекта межжелудочковой перегородки
В возрасте 3-4-лет, по мере нарастания сердечной недостаточности, у таких детей появляются жалобы на сердцебиение и боли в области сердца, склонность к носовым кровотечениям и обморокам. Транзиторный цианоз сменяется постоянным пероральным и акроцианозом; беспокоит постоянная одышка в покое, ортопноэ, кашель (синдром Эйзенменгера). На наличие хронической гипоксии указывают деформация фаланг пальцев и ногтей («барабанные палочки», «часовые стекла»).
При обследовании выявляется «сердечный горб», развитый в меньшей или большей степени; тахикардия, расширение границ сердечной тупости, грубый интенсивный пансистолический шум; гепатомегалия и спленомегалия. В нижних отделах легких выслушиваются застойные хрипы.
Диагностика дефекта межжелудочковой перегородки
К методам инструментальной диагностики дефекта межжелудочковой перегородки относятся ЭКГ, ФКГ, рентгенография грудной клетки, ЭхоКС, катетеризация камер сердца, ангиокардиография, вентрикулография.
Электрокардиограмма при дефекте межжелудочковой перегородки отражает перегрузку желудочков, наличие и степень выраженности легочной гипертензии. У взрослых больных могут регистрироваться аритмии (экстрасистолия, мерцание предсердий), нарушения проводимости (блокада правой ножки пучка Гиса, синдром WPW). Фонокардиография фиксирует высокочастотный систолический шум с максимумом в III-IV межреберье слева от грудины.
Эхокардиография позволяет выявить дефект межжелудочковой перегородки или заподозрить его по характерным нарушениям гемодинамики. Рентгенография органов грудной клетки при больших дефектах межжелудочковой перегородки обнаруживает усиление легочного рисунка, усиленную пульсацию корней легких, увеличение размеров сердца. Зондирование правых полостей сердца выявляет повышение давления в легочной артерии и правом желудочке, возможность проведения катетера в аорту, повышенную оксигенацию венозной крови в правом желудочке. Аортография проводится для исключения сопутствующих ВПС.
Дифференциальная диагностика дефекта межжелудочковой перегородки проводится с открытым атриовентрикулярным каналом, общим артериальным стволом, дефектом аортолегочной перегородки, изолированным стенозом легочной артерии, стенозом аорты, врожденной митральной недостаточностью, тромбоэмболией.
Лечение дефекта межжелудочковой перегородки
Асимптомное течение дефекта межелудочковой перегородки при его небольших размерах позволяет воздержаться от хирургического вмешательства и осуществлять динамическое наблюдение за ребенком. В ряде случаев возможно спонтанное закрытие дефекта межжелудочковой перегородки к 1-4 годам жизни или в более позднем возрасте. В остальных случаях показано хирургическое закрытие дефекта межжелудочковой перегородки, как правило, после достижения ребенком 3-х лет.
При развитии сердечной недостаточности и легочной гипертензии проводится консервативное лечение с помощью сердечных гликозидов, мочегонных препаратов, ингибиторов ангиотензинпревращающего фермента, кардиотрофиков, антиоксидантов.
Кардиохирургическое лечение дефекта межжелудочковой перегородки может быть радикальным и паллиативным. К радикальным операциям относятся ушивание малых дефектов межжелудочковой перегородки П-образными швами; пластика больших дефектов синтетической (тефлон, дакрон и др.) заплатой или биологической (консервированный ксеноперикард, аутоперикард) тканью; рентгенэндоваскулярная окклюзия дефекта межжелудочковой перегородки.
У грудных детей с выраженной гипотрофией, большим лево-правым шунтированием крови и множественными дефектами предпочтение отдается паллиативной операции, направленной на создание искусственного стеноза легочной артерии с помощью манжетки. Данный этап позволяет подготовить ребенка к радикальной операции по устранению дефекта межжелудочковой перегородки в более старшем возрасте.
Течение беременности при дефекте межжелудочковой перегородки
Женщины с небольшим дефектом межжелудочковой перегородки, как правило, в состоянии нормально выносить и родить ребенка. Однако, при больших размерах дефекта, аритмии, сердечной недостаточности или легочной гипертензии риск осложнений во время беременности значительно повышается. Наличие синдрома Эйзенменгера является показанием для искусственного прерывания беременности. У женщин с дефектом межжелудочковой перегородки имеется повышенная вероятность рождения ребенка с аналогичным или другим врожденным пороком сердца.
Перед планированием беременности пациентке с пороком сердца (оперированным или нет) необходимо проконсультироваться с акушером-гинекологом, кардиологом, генетиком. Ведение беременности у категории женщин с дефектом межжелудочковой перегородки требует повышенного внимания.
Прогноз при дефекте межжелудочковой перегородки
Естественное течение дефекта межжелудочковой перегородки в целом не позволяет надеяться на благоприятный прогноз. Продолжительность жизни при данном пороке зависит от величины дефекта и составляет в среднем около 25 лет. При больших и средних дефектах 50-80% детей умирают в возрасте до 6 мес. или 1 года от сердечной недостаточности, застойной пневмонии, бактериального эндокардита, нарушений ритма сердца, тромбоэмболических осложнений.
В редких случаях ДМЖП не оказывает существенного влияния на продолжительность и качество жизни. Спонтанное закрытие дефекта межжелудочковой перегородки наблюдается в 25-40% случаев, преимущественно при его малом размере. Однако даже в этом случае больные должны находиться под наблюдением кардиолога в связи с возможными осложнениями со стороны проводящей системы сердца и высоким риском возникновения инфекционного эндокардита.
Дефект межжелудочковой перегородки
Дефект межжелудочковой перегородки (ДМЖП) – врожденный порок сердца, при котором наблюдается нарушение целостности перегородки между правым и левым желудочками. В результате кровь из одного желудочка попадает в другой и нарушает нормальную работу сердца и кровообращения в организме. Иногда перегородка отсутствует вовсе. ДМЖП образуется в результате нарушения эмбрионального развития в утробе матери. Часто заболевание сопровождается другими сердечными пороками. ДМЖП у взрослых может появиться при разрыве межжелудочковой перегородки при остром инфаркте миокарда.
Причины возникновения дефекта межжелудочковой перегородки
Как было сказано ранее, ДМЖП формируется на стадии эмбриона. Будущим мамам важно с осторожностью относиться к своему здоровью и здоровью развивающегося плода. Поэтому необходимо оградить себя и будущего ребенка от воздействия негативных факторов, таких как:
Симптомы дефекта межжелудочковой перегородки
Т.к. порог врожденный, первые симптомы могут появиться при первых днях жизни:
При небольших дефектах внешние симптомы могут не проявляться и обнаруживаются только при выслушивании сердца.
Патология может не давать знать о себе до взрослого возраста. Симптоматика у зрелого человека практически такая же, как и у ребенка. Дополнительно могут быть жалобы на:
Если вы заметили у своего ребенка или у себя схожие симптомы, обратитесь к врачу. В кардиологическом центре ФНКЦ ФМБА проводятся комплексные программы по исследованию сердца. Запишитесь на прием к кардиологу, чтобы своевременно купировать недуг и предотвратить развитие заболевания.
Диагностика
Диагностировать ДМЖП у эмбриона возможно во время беременности уже на втором-третьем триместре при проведении скрининговых УЗИ. Зная о пороке сердца, родители наперед понимают, какие обследования необходимо будет провести ребенку после рождения:
Для взрослого пациента, не знающего о своем диагнозе, врачом проводится первичный опрос и осмотр. Измеряется давление, выслушивается сердце. После сбора анамнеза выдается направление на лабораторные анализы и инструментальное исследование. К вышеперечисленным могут быть добавлены:
Профилактика
Особых требований по профилактике ДМЖП нет. Врачи могут дать несколько рекомендаций беременным женщинам, чтобы предотвратить развитие заболевания у будущего ребенка:
При своевременном обнаружении патология легко лечится. Не теряйте ни минуты! Пройдите обследование вашего сердца, чтобы не допустить осложнений.
Лечение дефекта межжелудочковой перегородки
При обнаружении дефекта межжелудочковой перегородки у эмбриона, лечение могут отложить до года, т.к. есть вероятность, что нарушение пройдет самостоятельно. В остальных случаях необходимо лечение.
В кардиологическом центре ФНКЦ ФМБА лечение ДМЖП у взрослых (старше 18 лет) проводится с помощью медикаментозных препаратов или с помощью хирургического вмешательства. Медикаментозное лечение может проводиться амбулаторно либо под присмотром специалистов в терапевтическом отделении нашего центра. Назначение препаратов зависит от степени поражения перегородки и от наличия сопутствующих недугов. Это могут быть бета-блокаторы, препараты снижающие нагрузку на сердце. Перечень препаратов и их дозировку определяет строго лечащий врач-кардиолог.
Второй метод – пластика дефекта. Операция проводится на открытом сердце с помощью вскрытия грудной клетки. Перед началом процедуры пациента подключают к аппарату искусственного кровообращения. Сердце разрезают и дефект ушивают дефект с помощью заплаты из искусственной или собственного перикарда, который фиксируют швами по краям дефекта. Метод более травматичный и требует более длительной реабилитации около месяца. Если ДМЖП произошло в остром периоде инфаркта миокарда, то хирургическое лечение проводят или в первые же сутки или в подостром периоде, что более безопасно.
Интактная межжелудочковая перегородка что это

Поиск
Критический порок сердца (атрезия легочной артерии с интактной межжелудочковой перегородкой) в педиатрической практике
1 Казанский государственный медицинский университет МЗ РФ, г. Казань
2 Детская республиканская клиническая больница МЗ РТ, г. Казань
Контактная информация
Соловьёва Наиля Анасовна — кандидат медицинских наук, доцент кафедры госпитальной педиатрии
Адрес: 420012, г. Казань, ул. Бутлерова, д. 49, тел.: +7 (843) 556-74-52, e-mail: [email protected]
Атрезия легочной артерии с интактной межжелудочковой перегородкой является редким критическим ВПС, при котором отсутствует сообщение между правым желудочком и легочной артерией и жизнь новорожденного зависит от функционирования открытого артериального протока. В статье представлено клиническое наблюдение за ребенком, в первые часы жизни которого диагностирована атрезия клапана легочной артерии. ОАП. Открытое овальное окно. Дуктус-зависимая легочная циркуляция. В кардиохирургическом отделении была проведена операция: открытая вальвулопластика клапана легочной артерии и создание системно-легочного анастомоза в модификации. После выписки на 18 день жизни девочка находилась под наблюдением участкового педиатра с регулярным контролем клинико-лабораторных данных и инструментальных методов исследования (ЭКГ, эхокардиография, измерение сатурации кислорода) и консультацией кардиолога и кардиохирурга. В возрасте 2 лет 5 месяцев проведена радикальная операция: пластика клапана легочной артерии, пластика трикуспидального клапана, пластика правой ветви легочной артерии, ликвидация системно-легочного анастомоза, пластика ДМПП в условиях искусственного кровообращения. Выписана пациентка с выздоровлением. Тщательное мониторирование состояния здоровья ребенка педиатром, кардиологом и кардиохирургом позволило при наблюдении в амбулаторных условиях предотвратить возникновение осложнений в послеоперационном периоде, определить оптимальные сроки анатомической радикальной коррекция порока, что привело к полному выздоровлению и обеспечило гармоничное развитие девочки.
Ключевые слова: дети, критический порок сердца, коррекция, мониторирование состояния.
1 Kazan State Medical University Ministry of Health of the Russian Federation, Kazan
2 Children’s Republican Clinical Hospital of the Ministry of Health of Republic of Tatarstan, Kazan
Critical heart disease (atresia of the pulmonary artery with an intact interventricular septum) in pediatric practice
Contact details:
Solovyeva N.A. — PhD (medicine), Associate Professor of the Department of Hospital Pediatrics
Address: 49 Butlerov St., Russian Federation, Kazan, 420012, tel.: +7 (843) 556-74-52, e-mail: [email protected]
Atresia of the pulmonary artery with an intact interventricular septum is a rare critical heart disease (CHD) in which there is no communication between the right ventricle and the pulmonary artery and the life of a newborn depends on the functioning of the open arterial duct. The article presents a clinical observation of a child diagnosed in the first hours of life with Atresia of the pulmonary artery valve. Open arterial duct. Open oval window. Ductus-dependent pulmonary circulation. In the Cardiac Surgery Department, an operation was performed: open valvuloplasty of the pulmonary artery valve and creation of a systemic pulmonary anastomosis in modification. After discharge on the 18 th day of life, the patient was under the supervision of a district pediatrician with regular monitoring of clinical and laboratory data and instrumental research methods (ECG, echocardiography, measurement of oxygen saturation) and consultation with a cardiologist and cardiac surgeon. At the age of 2 years 5 months radical surgery was performed: Plastic valve pulmonary artery, tricuspid valve plasty, plasty of the right branch of the pulmonary artery, the elimination of systemic-pulmonary anastomosis, plastic ASD in conditions of artificial circulation. The patient was discharged with recovery. Careful monitoring of the child’s health by a pediatrician, cardiologist and cardiac surgeon allowed preventing the occurrence of complications in the postoperative period and determining the optimal timing of anatomical radical correction of the defect, which led to full recovery and ensured the harmonious development of the girl.
Key words: children, critical heart disease, correction, condition monitoring.
Врожденные пороки сердца (ВПС) составляют около 30% от всех аномалий развития у детей и являются одними из самых распространенных пороков в настоящее время. Несмотря на большие достижения в диагностике и коррекции врожденных пороков сердца, эта проблема остается актуальной в педиатрии в настоящее время. Частота ВПС во всех странах мира, включая Россию, достигает от 2,4 до 14,2 на 1000 новорожденных. Среди всех причин смерти от пороков развития врожденные пороки сердца и сердечно-сосудистой системы составляют 47% (12,2 на 10 тыс. родившихся живыми). Суммарная летальность при врожденных пороках сердца высока. К концу 1-й недели умирают 29% новорожденных, к 1-му месяцу — 42%, к 1-му году — 87% детей [1–6]. Критические пороки составляют приблизительно 25% всех врожденных пороков сердца. Угрожающие состояния, развивающиеся у новорожденных с критическими ВПС, при которых гемодинамика зависит от функционирования фетальных коммуникаций, требуют оперативной коррекции в первые дни жизни. Среди критических ВПС доля атрезии легочной артерии составляет 3–5% [7].
Несмотря на интенсивное развитие диагностических методик и улучшение визуализирующего оборудования, антенатально выявляются в среднем 35–40% пороков сердца [8, 9]. С учетом высокой частоты летальных исходов, обусловленных поздней диагностикой критических врожденных пороков сердца, в настоящее время все большее внимание уделяется внедрению неонатального скрининга [6]. Пороки сердца, сопровождаемые гипоксемией, можно потенциально обнаружить при проведении пульсоксиметрии. В Республике Татарстан в 2018 г. был реализован проект «Неонатальный скрининг жизнеугрожающих состояний: персистирующей легочной гипертензии новорожденных и критических врожденных пороков сердца методом пульсоксиметрии» (приказ МЗ РТ от 21.05.2018 № 1199), внедрение которого позволило значительно улучшить диагностику и максимально сократить время до начала необходимого оперативного вмешательства.
В число критических врожденных пороков сердца входит атрезия легочной артерии, которая пренатально диагностируется в 41,1% случаев [9]. Это редкий критический ВПС, при котором отсутствует сообщение между правым желудочком (ПЖ) и легочной артерией (ЛА) и жизнь новорожденного зависит от функционирования открытого артериального протока (ОАП), то есть имеется дуктус-зависимый легочный кровоток. После рождения пациенты имеют выраженные клинические проявления от цианоза до кардиогенного шока, вызванного закрытием артериального протока, и находятся в крайне тяжелом состоянии, что требует своевременной диагностики и раннего оперативного лечения [10]. Операции предшествует первоначальная стабилизация новорожденных внутривенной инфузией простагландина Е1. У большинства больных необходимо хирургическое лечение в несколько этапов [7].
Главной целью ранних паллиативных вмешательств является устранение гипоксемии, зависимости от функционирования ОАП, а также восстановление прямого легочного кровотока. Хирургический метод оперативного вмешательства включает в себя операции по созданию системно-легочного анастомоза, формированию выхода из правого желудочка в легочную артерию путем пластики клапана легочной артерии. Клапан легочной артерии представлен либо мембраной из фиброзной ткани, либо полностью сросшимися по комиссурам створками, облитерирующими выход из полости правого желудочка. Альтернативный эндоваскулярный метод лечения позволяет выполнить формирование выхода из ПЖ в ЛА с последующей транслюминальной баллонной вальвулопластикой. Устранение обструкции выхода из правого желудочка способствует росту структур правого сердца. При наличии нормальных размеров ПЖ возможна анатомическая радикальная коррекция порока, что ведет к полному выздоровлению [6, 11, 12].
Приводим собственное клиническое наблюдение за ребенком с критическим ВПС (атрезией легочной артерии с интактной межжелудочковой перегородкой).
Под наблюдение врача педиатра участкового поступила девочка в возрасте 18 дней после открытой вальвулопластики клапана легочной артерии и создания системно-легочного анастомоза, проведенных в кардиохирургическом отделении ДРКБ МЗ РТ.
Ребенок родился от 2 беременности и первых срочных родов в октябре 2016 г. Первая беременность закончилась медицинским абортом. Данная беременность протекала на фоне субклинического гипотиреоза, кандидозного кольпита, обострения хронического пиелонефрита и ОРВИ в первом триместре. ВПС пренатально не диагностирован. Роды с преждевременным отхождением околоплодных вод. Масса при рождении — 3600 г, рост — 53 см. Закричала сразу, оценка по шкале Апгар — 8–9 баллов. Крик громкий, кожа бледная, чистая. Дыхание проводилось по всем полям, частота дыхания — 44 в минуту. Тоны сердца ритмичные, выслушивался систолический шум 2/6 вдоль левого края грудины, ЧСС —156 в минуту. Живот мягкий, печень пальпировалась + 1 см из-под края реберной дуги. Состояние при рождении оценивалось как удовлетворительное. Однако в течение первого часа жизни появилась одышка до 70 дыхательных движений в минуту, было выявлено прогрессирующее снижение сатурации кислорода до 70%. После консультации кардиолога и проведения ЭХО-КГ выставлен диагноз: атрезия клапана легочной артерии. ОАП. Открытое овальное окно. Дуктус-зависимая легочная циркуляция. С целью поддержания функционирования ОАП в/в назначена инфузия алпростадила в дозе 0,05 мкг/кг/мин. Ребенок в тяжелом состоянии экстренно был переведен в кардиохирургическое отделение ДРКБ МЗ РТ.
При поступлении в стационар состояние ребенка тяжелое за счет критического ВПС, сердечной недостаточности, дуктус-зависимой легочной циркуляции. Одышка с ЧДД 74 в минуту, сатурация кислорода 91% (на фоне титрования алпростадила), гепатомегалия (+ 3 см).
В течение первых суток жизни было проведено эндоваскулярное вмешательство: зондирование полостей сердца (ЗПС) справа с попыткой транслюминальной балонной вальвулопластики легочной артерии. При проведении ЗПС, инвазивном измерении давления в полостях сердца и магистральных сосудах, ангиокардиографии выявлено отсутствие кровотока через клапан легочной артерии. Проведены многократные безуспешные попытки катетеризации легочной артерии, в связи с чем была проведена операция в условиях искусственного кровообращения: открытая вальвулопластика клапана легочной артерии и создание системно-легочного анастомоза в модификации. Послеоперационный период протекал с умеренно выраженной сердечной недостаточностью, продолжительность ИВЛ составила 139 ч.
Девочка выписана домой на 18 день после операции с удовлетворительным самочувствием, с положительной динамикой массы тела (+ 578 г). Сатурация кислорода при выписке — 95%. Рекомендовано продолжить прием аспирина 15 мг 1 раз в день и капотена 3 мг 2 раза в день, наблюдение кардиолога и врача педиатра по месту жительства, консультация кардиохирурга через 1 месяц. Также необходима профилактика инфекционного эндокардита.
Рекомендации врачей выполнялись в полном объеме, ребенку был организован хороший уход. До года девочка находилась на грудном вскармливании, своевременно введен полноценный прикорм. Физическое и нервно-психическое развитие ребенка в первые два года соответствовало возрасту. Перенесенные заболевания: 2–3 раза в год ОРИ, во всех случаях проводилась профилактика инфекционного эндокардита. Детские образовательные учреждения девочка не посещала. Ребенок находился под наблюдением кардиолога и кардиохирурга (1 раз в 3 месяца) с регулярным контролем клинико-лабораторных данных и инструментальных методов исследования (ЭКГ и эхокардиография).
При динамическом наблюдении педиатром проводился контроль прибавки веса, показателей нервно-психического развития, функционального состояния органов и систем, лабораторных и инструментальных методов исследования, контроль сатурации кислорода. В феврале 2019 г. при плановом осмотре родители отметили одышку при физической нагрузке. Ребенок был направлен на консультацию к кардиологу. По результатам эхокардиографического исследования выявлен выраженный рестеноз клапана легочной артерии. Заключение по Эхо-КГ: атрезия легочной артерии с интактной межжелудочковой перегородкой. Недостаточность трикуспидального клапана 2–3 степени. Дилятация правого предсердия. Множественные ДМПП. Состояние после операции: открытая вальвулопластика клапана легочной артерии и создание системно-легочного анастомоза. Рестеноз клапана легочной артерии, выраженный. После консультации кардиохирурга было принято решение о проведении второго этапа оперативного лечения.
Для уточнения анатомии системы легочной артерии и функционального состояния желудочков перед операцией проведена магнитно-резонансная томография сердца и магистральных сосудов по протоколу, включающему импульсные последовательности ЭКГ-синхронизированного градиентного эхо в кино-режиме (CINE) c использованием стандартных позиций 4-х и 2-камерной плоскости ЛЖ и серии срезов по короткой оси сердца для оценки параметров глобальной и регионарной функции, дополненной болюсная МР-ангиографии сосудов органов грудной клетки ОГК. По результатам МРТ выявлены признаки гипертрофии ПЖ (толщина передней стенки до 4 мм) с сохранной насосной функцией (ФВ ПЖ 62%), дилатации правого предсердия с признаками значимой недостаточности на ТК. МР-ангиография демонстрирует значимое сужение правой ветви ЛА до 4 мм на протяжении 15 мм (рис. 1).
Рисунок 1. МРТ сердца в режиме градиентного эхо Cine SSFP в 4-камерной проекции демонстрирующее увеличение правого предсердия (а), серии срезов по короткой оси (b, c) демонстрирующее гипертрофию правого желудочка (указано стрелками). Болюсная МР-ангиография сосудов ОГК с 3D реконструкцией, демонстрирующая сужение правой ветви ЛА на протяжении (d, e, f) (указано стрелкой)
Figure 1. MRT of heart in the gradient echo regime Cine SSFP in a 4-chamber projection, demonstrating dilatation of the right auricle (a); a series of sections along the short axis (b, c) demonstrates hypertrophy of the right ventricle (shown by arrows). Bolus MR angiography of the chest vessels with 3D reconstruction, demonstrating contraction of the right branch of pulmonary artery along (d, e, f) (shown by an arrow)
На основании полученных данных было принято решение о выполнении анатомической радикальной коррекция порока.
В возрасте 2 лет 5 месяцев проведена операция «Пластика клапана легочной артерии, пластика трикуспидального клапана, пластика правой ветви легочной артерии, ликвидация системно-легочного анастомоза, пластика ДМПП в условиях искусственного кровообращения». Послеоперационный период протекал без осложнений, ИВЛ в течение 4 ч. ЭКГ перед выпиской: синусовый ритм с ЧСС 128 ударов в минуту. Отклонение электрической оси вправо. Конфигурация QRS типа SI QIII. Нарушение внутрипредсердной проводимости. Неполная блокада правой ножки пучка Гиса. ЭКГ признаки увеличения правого желудочка.
Выписана пациентка с выздоровлением. Рекомендовано наблюдение кардиолога и педиатра, прием ингибиторов АПФ (капотен по 6, 25 мг 3 раза в день) и диуретиков (верошпирон 12,5 мг в 16:00 и в 20:00), профилактика инфекционного эндокардита.
Тщательное мониторирование состояния здоровья ребенка педиатром, кардиологом и кардиохирургом позволило при наблюдении в амбулаторных условиях предотвратить возникновение осложнений в послеоперационном периоде, определить оптимальные сроки анатомической радикальной коррекция порока, что привело к полному выздоровлению и обеспечило гармоничное развитие девочки.
Эффективную квалифицированную специализированную помощь детям с критическими врожденными пороками сердца возможно оказать лишь при комплексном участии акушеров-гинекологов, врачей ультразвуковой диагностики, неонатологов, детских кардиохирургов, кардиологов и педиатров. При этом очень важна роль участкового врача-педиатра на этапе реабилитации и длительного диспансерного наблюдения.