Инвазивный рост опухоли что это такое простыми словами
Что такое первичный рак неизвестного происхождения?
Раковая опухоль возникает в случаях, когда клетки начинают бесконтрольно расти. Такую особенность могут приобрести клетки практически любого органа. Кроме того, по мере роста опухоли они с током крови или лимфы могут переноситься в другие области тела, оседать там и давать начало росту новых очагов. Такие очаги называют вторичным раком, или метастазами, а начальную опухоль, соответственно, первичным раком.
Метастазы в любых органах классифицируют в зависимости от того, из какого органа изначально происходит опухоль. Например, вторичный очаг рака легких в печени все равно будет называться раком легких, только получит приставку «вторичный». Иногда не получается определить, в каком именно органе сначала возникла опухоль. Однако при исследовании выявляются ее метастазы в других частях тела. Если их первичный очаг определить не удается, то врачи говорят про первичный рак неизвестного происхождения, или скрытый первичный рак.
Пример выявления
Скрытый первичный рак встречается нечасто. Более того, в ходе дальнейших обследований первичный очаг может обнаружиться. Если так происходит, то опухоль более не считается первичным раком неизвестного происхождения. Ей присваивают название в соответствии с органом происхождения и, опираясь на новые данные, модифицируют схему лечения онкологического заболевания.
На практике это происходит следующим образом:
Однако в ряде случаев даже самое тщательное обследование не позволяет обнаружить первичный очаг. Более того, его не всегда получается найти даже при патологоанатомическом исследовании.
Типы раковых опухолей
Обычно опухоли классифицируют по их первичной локализации. Однако их также можно сгруппировать по типам клеток, по тому, как раковые клетки выглядят под микроскопом. Знание типа клетки может дать врачам ключ к пониманию того, из каких тканей или органов происходит данная опухоль.
Карциномы
Карцинома — это рак, который происходит из клеток, выстилающих внутреннюю или внешнюю поверхности различных органов нашего тела. Такие клетки называются эпителиальными. Наиболее распространенные типы карцином:
1) Плоскоклеточный рак
Самым ярким примером плоских клеток являются клетки, встречающиеся на поверхности кожи. Кроме того, они составляют часть слизистых оболочек многих полых органов. Плоскоклеточный рак может возникать в ротовой полости, в горле, пищеводе, легких, прямой кишке, на шейке матки, во влагалище и некоторых других органах.
2) Аденокарциномы
Эти злокачественные новообразования развиваются из железистых клеток, то есть из тех, которые способны производить какие-либо вещества. Железистые клетки входят в состав очень многих органов нашего тела, в том числе и тех, которые формально не считаются железами. Например, большинство видов раковых опухолей желудка, кишечника и толстой кишки представляют собой именно аденокарциномы и примерно 4 из 10 случаев рака легких также являются аденокарциномами.
Другие виды злокачественных опухолей
Из других типов клеток раковые новообразования возникают реже. К таким опухолям относятся:
Итак, при первичном раке неизвестного происхождения не всегда получается установить орган, где изначально возникла опухоль. Однако, исследуя под микроскопом клетки вторичного очага, чаще всего удается отнести их к одной из пяти категорий:
В дальнейшем эта информация поможет более точно идентифицировать опухоль и в конечном итоге обнаружить ее первичный очаг.
Зачем нужно искать первичный очаг?
Основная причина для поисков начальной опухоли — выбор правильной тактики лечения. Вторичные метастатические очаги состоят из тех же клеток, что и начальная опухоль, даже если развиваются в совершенно других органах. Значит, для их лечения будут эффективны те же препараты, что и для терапии первичного рака, а не те, которые используются при лечении онкопатологий органа, где развился метастаз.
Это имеет особенно важное значение при некоторых формах рака, которые хорошо поддаются лечению определенными химиотерапевтическими или гормональными препаратами. Например, такими особенностями характеризуются многие опухоли молочной железы. Их можно эффективно лечить гормональными средствами. А значит, такие же препараты подойдут и для терапии их метастазов в костях, головном мозге, печени.
К сожалению, предугадать развитие злокачественного заболевания пока практически невозможно. А потому наиболее эффективным способом борьбы с опухолями является выявление рака на 1 стадии развития. В этом случае успешному лечению поддаются более 90% всех злокачественных новообразований. Обнаружить опухоль на начальных этапах возникновения можно только при помощи периодических скринигов. Такие скрининговые программы действуют и в медицинском центре «Анадолу». На первичной консультации специалист-онколог оценит риск развития у вас онкологического заболевания и составит индивидуальный план прохождения профилактических обследований для ранней диагностики рака.
Материал подготовлен по согласованию с врачом «Анадолу», терапевтом и медицинским онкологом Шерефом Комурджу.
Инвазивный рост опухоли что это такое простыми словами
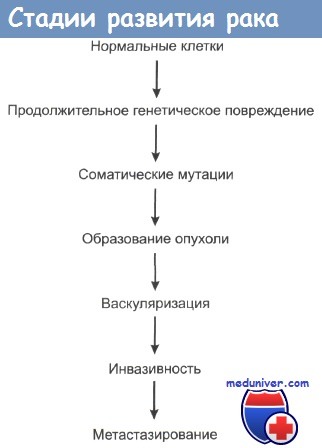
Можно сказать, что раковые клетки в определенной степени не реагируют на механизмы, контролирующие рост и развитие нормальной ткани. При пролиферации нормальной ткани непосредственный контакт клетки со своими соседями обычно служит сигналом к прекращению размножения. Это контактное торможение отсутствует в опухолевых тканях.
При подкожном введении раковых клеток иммунодефицитным мышам происходит рост и развитие опухоли, что никогда не случается при введении здоровых клеток. Раковые клетки отличаются от здоровых по составу мембранных гликопротеинов, по микропотенциалам на клеточной мембране, а также характеризуются повышенным содержанием сиаловой кислоты. Локомоторный клеточный аппарат (микротрубочки и микрофиламенты) раковых клеток деградирует, клетка теряет присущие ей формы, отмечается миграция цитоплазмы раковой клетки в зону контакта со здоровыми клетками.
Одновременно раковые клетки становятся локально инвазивными, хотя биохимические основы этого свойства до сих пор четко не выявлены. Опухолевые клетки часто демонстрируют пониженную адгезивность в сравнении с нормальными клетками. Важным моментом механизма инвазии является секреция определенных ферментов. Некоторые ферменты играют ключевую роль в протеолизе внутриклеточного матрикса, который всегда сопровождает инвазию раковых клеток. К таким ферментам относится семейство матричных металлопротеиназ (ММП), которое включает в себя колллагеназы, желатиназы и стромолизины.
Эти ферменты экскретируются в неактивной форме. Последующий разрыв сульфгидрильной группы и присоединение атома металла (чаще всего цинка) приводят к изменению конформации фермента и переводят его в активное состояние. Тканевые ингибиторы металлопротеиназ (ТИМП) прекращают действие этих ферментов. Некоторые типы тканей изначально обладают повышенной устойчивостью к инвазии. Это, например, компактная костная ткань, ткани крупных сосудов и хрящевая ткань. Предположительно способность к инвазии у опухолевых клеток появляется в результате трансформации нормальных процессов реконструкции и восстановления здоровых тканей. Тем не менее к настоящему моменту неизвестно, какие конкретно изменения генетической структуры раковых клеток ответственны за инвазивный рост.
По мере роста опухоли она выделяет в кровь ангиогенные факторы, которые стимулируют прорастание опухоли кровеносными сосудами и формирование сети капилляров. Сосудистая система кровоснабжения опухоли может стать мишенью для различных видов противораковой терапии. Опухоль стимулирует пролиферацию эндотелиальных клеток, выделяя ангиогенные цитокины, такие как эндотелиальный фактор роста сосудов (ЭФРС), ТФР и факторы роста фибробластов. Эндотелиальные же клетки в свою очередь могут стимулировать рост клеток опухоли. В одном грамме опухолевой ткани может находиться до 10-20 млн эндотелиальных клеток, которые не являются неопластическими.
Антигены нормальных эндотелиальных клеток, включая и профакторы свертываемости крови, могут быть разрегулированы в активно пролиферирующей под действием опухоли эндотелиальной ткани. В дополнение к действию цитокинов, гипоксия, развивающаяся в сети опухолевого кровоснабжения, может стимулировать выбросы ЭФРС и других факторов. В ходе ангиогенеза эндотелиальные клетки внедряются в строму опухоли, активно делятся там с образованием зачатков новых капилляров, которые затем развиваются в сосудистую систему опухоли. Как и в случае инвазии опухолевых клеток, этот процесс идет с участием продуцируемых эндотелием ММП и их естественных ингибиторов.
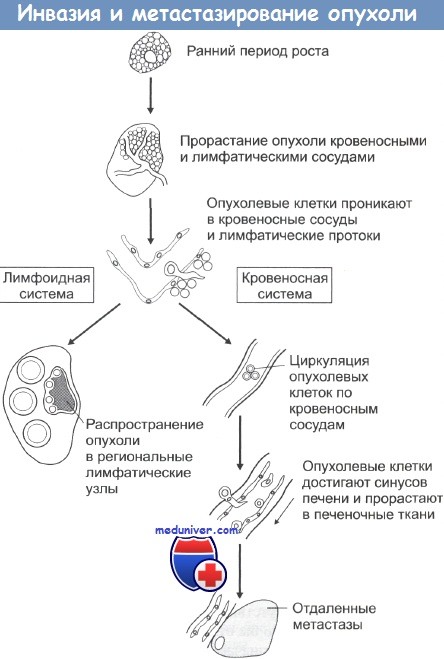
При локальной инвазии рака опухолевые клетки могут попадать в сосудистую систему и давать начало метастазам. Последовательность событий при метастазировании показана на рисунке. Распространение раковых клеток по лимфатической системе, что особенно характерно при карциномах, происходит при попадании опухолевых клеток в лимфатические протоки с последующим оседанием их в местах разветвления протоков и в ближайших лимфатических узлах. Вслед за этим обычно происходит инфильтрация опухолевыми клетками и отдаленных лимфоузлов. Распространение через кровяное русло проходит при проникновении раковых клеток в кровеносные сосуды рядом с местом первичной локализации опухоли либо через грудные протоки. Подхваченные током крови раковые клетки затем захватываются ближайшими капиллярными сетями, чаще всего сетями печени и легких, и оседают в них. При оценке направлений метастазирования очень важно учитывать первичную локализацию опухоли.
Например, опухоли пищеварительного тракта обычно метастазируют через воротную вену в печень. Опухоли также могут метастазировать непосредственно сквозь прилегающие ткани. Так возникающие в брюшной полости новообразования могут очень быстро рассеяться по всему внутрибрюшинному пространству, а клетки рака легкого могут мигрировать через плевру. Некоторые опухоли метастазируют в определенные органы и ткани, другие — бессистемно. Саркомы, например, почти всегда метастазируют в легкие, рак молочной железы поражает также ткани осевого скелета. Тем не менее биологических механизмов, объясняющих такую избирательность, пока не найдено.
Региональные лимфоузлы могут осуществлять барьерную функцию, предотвращая распространение метастазов за пределы области первичной локализации опухоли. До сих пор четко не выяснено, каким образом и за счет каких специфических иммунных механизмов лимфатические узлы создают барьер на пути распространения опухоли.
Проникая в кровеносное русло в районе первичной опухоли, раковые клетки затем могут достигать других органов и тканей. Для того чтобы дать начало новым очагам опухоли, эти клетки на новом месте должны, во-первых, проникнуть в ткани через эндотелий капилляров, а во-вторых, выжить при атаках местных иммунных систем защиты, таких как фагоцитирующие клетки и так называемые естественные киллеры (ЕК).
Способность к инвазированию и расселению в отдаленных органах и тканях у различных видов опухолей сильно варьирует. Эта способность, по-видимому, определяется степенью экспрессии того участка генома, который и обусловливает злокачественный рост клеток. Действительно, со временем почти все раковые опухоли накапливают все больше и больше генетических изменений в своих клетках и приобретают способности к инвазии и метастазированию. Но даже при клиническом обнаружении опухоли метастазы и инвазия могут проявиться лишь спустя несколько лет. Типичным примером является карцинома низкой степени злокачественности. Следует отметить, что даже однотипные виды рака с одинаковой степенью дифференцированности опухолевых клеток по-разному метастазируют у разных больных.
Все это говорит о необходимости поиска молекулярных маркеров, которые смогли бы предсказывать исход течения онкологического заболевания более точно, чем диагностика по гистологическому типу опухоли (хотя последний метод в настоящее время является наиболее точным из всех возможных). Кроме того, даже конкретная опухоль может быть в значительной степени гетерогенной и состоять из клеток, различных по своему метастатическому потенциалу, что было показано на клонированных субпопуляциях, выделенных из одной опухоли. Биологические причины такой вариабельности в настоящее время неизвестны.
Совершенно ясно, что для успешного лечения онкологических пациентов необходимо проводить масштабные исследования в области нахождения механизмов тканевой инвазии, метастатического роста и поиска биологических причин гетерогенности опухолей. Отсутствие гомогенности в опухолях, сходство опухолевых клеток со здоровыми клетками породившей ее ткани, и отсутствие четкого единичного критерия, по которому можно было бы отличить раковую клетку от здоровой, — все это вместе означает, что наши рассуждения о противоопухолевом иммунитете или о механизмах действия лекарственных цитостатических препаратов должны приниматься с изрядной долей скептицизма, особенно если они базируются на экспериментах с гомогенными опухолевыми культурами.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Лечение инвазивного рака мочевого пузыря
Даренков С.П. (доклад, Российское общество урологов).
Рак мочевого пузыря – самое распространенное онкологическое заболевание в урологии, после рака простаты. В западной Европе и Северной Америке диагностируется ежегодно более 18 случаев рака мочевого пузыря на 100 000 населения.
Заболеваемость раком мочевого пузыря и у нас в стране остается высокой.
Переходно-клеточная карцинома (ПКК) вывяляется в 96% опухолей мочевого пузыря. Примерно две третьих являютя неинвазивными высоко дифференцированными, папилярными образованиями, генетически главным образом характеризующиеся повреждением 9 хромосомы. Оставшееся треть раков мочевого пузыря является в большинстве низкодифференцированной ПКК с изменениями в 17 хромосоме и высокой склонностью к прогрессированию. Последние являются “убивающими” раками с наиболее неблагоприятным прогнозом, и их инвазивные формы представляют предмет нашего доклада.Уже при гистологическом подтверждении пенетрации базальной мембраны и инфильтрации собственной пластинки риск прогрессирования увеличивается шестикратно, даже при низкой градации ПКК. При клинически мышечно-инвазивном ограниченном органом заболевании более 25% пациентов имеют экстравезикальное распространение опухоли с ранним поражением региональных лимфатических узлов.
Даже если мышечно-инвазивный рак мочевого пузыря гистологически определяется как ограниченный органом процесс, после радикальной цистэктомии и расширенной лимфаденэктомии, более половины пациентов в конечном счете умирают от заболевания вопреки кажущемуся полному хирургическому удалению. Следовательно благоприятный период для излечения этих опухолей ограничен и недопустимы тактические ошибки или отсрочки.
Все это подтверждает необходимость совершенствования методов лечения больных мышечно-инвазивным РМП.
Ключем к правильной тактике лечения является точная гистологическая диагностика, основанная на послойной ТУР всех видимых опухолей. Вовлечение в процесс простатической части уретры у мужчин и шейки мочевого пузыря у женщин имеет важное значение для определения оперативной тактики и требует особого внимания.
Клиническое определение стадии заболевания ненадежно. Пространственное распространение опухоли, и в частности инфильтрация соседних органов или неподвижность мечевого пузыря обычно определяется опытными урологами при бимануальной пальпации под анестезией. Экстравезикальное распространение опухоли может быть диагносцировано с предельной точностью примерно в 70% при КТ и более чем в 85% при динамической МРТ с котрастным усилением. Верхние мочевые пути должны быть обследованы для исключения сопутствующей ПКК верхнего мочевого тракта, которая может иметь место более чем у 5% больных. Грудная клетка, кости и печень должны быть исследоваться на наличие метастазов.
Даже после тщательного предоперационного обследования, после радикальной цистэктомии с расширенной лимаденэктомией у половины пациентов с Т2N0M0 ПКК в итоге развивается рецидив заболевания вопреки казалось бы, радикальному удалению опухоли. Этот печальный факт подчеркивает агрессивный характер данного заболевания с быстрым метастатическим распространением.
В настоящее время существует два совершенно различных подхода к лечению мышечно-инвазивного РМП: это орган-сохраняющая тактика и орган-уносящая. В первом случае целью лечения является ликвидация новообразования консервативными или оперативными методами с сохранением функции мочевого пузыря. Во втором случае выполняется радикальная цистэктомия с различными видами отведения мочи или цистопластикой.
Идея сохранения мочевого пузыря при его новообразовании не нова. В ее основе лежит использование резекции мочевого пузыря, ТУР, химио- и лучевой терапии. Ранее эти методы использовались самостоятельно. Их эффективность была невысока. Органосохраняющие операции могут быть успешными только у тщательно отобранных пациентов.
По данным литературы 5-летняя выживаемость больных РМП, перенесших ТУР мочевого пузыря, составляет в зависимости от стадии от 4 до 36 %.
Эффективность системной химиотерапии также оставляла желать лучшего. По данным Roberts и соавт. применение метотрексата и цисплатины у пациентов с РМП в стадии Т3 и Т4 приводит к полной регрессии опухоли только у десятой части больных и у трети к частичной. Системная химиотерапия обладают токсичностью, которая является причиной различных осложнений.
По данным других исследователей почти 40 % больных, получающих системную химиотерапию, нуждаются в уменьшении начальных доз препаратов. При этом летальность после химиотерапии терапии составляет 4-23 %.
Использование радиотерапии в лечении РМП наиболее популярно в Канаде и Европе. Но использование ее как монотерапии также низкоэффективно. Ряд исследователей приводят данные о том, что 5-летняя выживаемость больных раком МП после лучевой терапии в зависимости от стадии составляет не более 60 %. К сожалению, лучевая терапия также является причиной многочисленных осложнений.
Последние 15 лет характеризуются переходом от монотерапии Р
5-летняя выживаемость больных раком МП после лучевой терапии в зависимости от стадии составляет не более 60 %
МП к комбинированным методикам лечения данной категории больных. Это привело к повышению выживаемости и возможности сохранения мочевого пузыря. Современный подход к лечению мышечно-инвазивного РМП включает ТУР опухоли МП, последующую индукционную химио- и радиотерапию. Ее результаты определяются при повторной ТУР. Больные с полной редукцией опухоли рассматриваются как кандидаты для сохранения мочевого пузыря. Им проводится консолидирующая терапия в виде повторной лучевой или химиотерапии. Пациентам с неполным ответом на индукционную терапию рекомендуется ЦЭ.
Предполагается, что недостаточная эффективность сочетанной химио-лучевой терапиии объясняется следующими обстоятельствами:
1. Резистентностью отдельных опухолевых клеток к химио-лучевой терапии;
2. изменением химиопрепаратами фенотипа, как опухолевых клеток, так и нормальных тканей, что увеличивает возможность появления новых метастазов;
3. Ни один из химиопрепаратов не способен поразить все опухолевые клетки.
Эти положения подтверждаются результатами других исследователей, согласно которым более, чем у половины больных раком МП, перенесших консервативную терапию, выявляли метастазы. Причем чаще развиваются отдаленные метастазы, чем региональные. Имеются данные, что рецидив рака МП может возникнуть и через 5 лет безрецидивного периода.
Таким образом, органосохраняющая тактика, включающая в себя ТУР опухоли и химиолучевую терапию, позволяет сохранять пузырь только у небольшой части больных с мышечно-инвазивным раком МП. Большая часть больных в дальнейшем нуждаются в спасительной цистэктомии.
Вторым и, пожалуй, основным направлением в лечении мышечно-инвазивного рака МП является орган-уносящая тактика. На протяжении последних 15-20 лет радикальная цистоэктомия является стандартом лечения мышечно-инвазивного РМП. В современных исследованиях радикальная цистэктомия постадийно показывает результат, стойко превышающий на 10-20% все другие методы лечения.
Исторически считается, что цистэктомия является наиболее опасным и технически сложным оперативным вмешательством в урологии. В 40-е годы XX столетия уровень летальности после цистэктомиии составлял 40-50 %, в наше время она снизилась до 1-3 %.
У данной категории больных инвазия опухоли в мышечный слой является основным и главным показанием для радикальной цистэктомии. Опоздание с правильно подобранным лечением у этих пациентов резко снижает выживаемость. Наиболее убедительным аргументом для ранней цистэктомии является значительное снижение смертности, достигнутое за последние 15 лет при использовании современной оперативной техники, улучшении предоперационной подготовки и появлении ортотопического замещения мочевого пузыря у мужчин и женщин. Смертность при цистэктомии снижена в современных работах даже у восьмидесятилетних.
Противопоказанием к ЦЭ является крайне тяжелый соматический статус пациента.
У мужчин стандартной операцией при мышечно-инвазивном раке мочевого пузыря является цистопростатвезмкулэктомия с тазовой лимфаденэктомией и удалением паравезикальной клетчатки. Уретрэктомия показана при инвазии опухоли в простатический отдел уретры, семявыносящие протоки или строму ПЖ.
У женщин, стандартная операция включает удаление мочевого пузыря, матки, маточных труб, яичников и передней стенки влагалища. Уретра должна обязательно удаляться при вовлечении в раковый процесс шейки мочевого пузыря или мочепузырного треугольника. Инвазивный рак мочевого пузыря рано метастазирует в лимфатические узлы. Стандартная лимфаденэктомия заключается в удалении всех обтураторных узлов, внутренних, наружных и общих подвздошных узлов, пресакральных узлов и узлов бифуркации аорты. Латеральной границей лимфаденэктомия является генитофеморальный нерв, каудальной границей – глубокая огибающая подвздошная вена, дорзальной границей – обтураторный нерв, и краниальной границей – уровень бифуркации аорты. Ретроспективными исследованиями доказано, что степень диссекции лимфоузлов имеет влияние на выживаемость. Доказано также, что пациенты с распространенным экстравезикальным заболеванием и крупными лимфатическими узлами имеют плохой прогноз, но посредством лимфаденэктомии и радикальной цистэктомии может быть излечена часть из них. Отказ от операции из-за обнаружения крупных лимфатических узлов является неоправданным.
Если в ходе оперативного вмешательства выявлена инвазия опухоли в мочеточники, то они должны быть пересечены проксимальнее опухоли.
При раке мочевого пузыря нервосберегающая методика цистэктомии, как при радикальной простатэктомии, позволяет сохранить эректильную функцию. При ограниченном инвазивном раке Schonberg и другие смогли сохранить потенцию у 72 % пациентов. В дальнейшем обнаружены тазовые рецидивы только у 6% больных. Venn и соавт. сообщают подобные результаты при комбинации с замещающей цистопластикой, и у пациентов даже после лучевой терапии.
Однако даже после этого вида оперативного лечения около четверти пациентов с мышечно-инвазивным раком мочевого пузыря в стадии Т2-Т3 умирают от рецидивов опухоли. Очевидно, что большинство из них имели метастазы. Поэтому неудивительно, что предоперационная лучевая терапия не увеличивает выживаемость пациентов по сравнению с одной цистэктомией. Напротив, сочетание цистэктомии с нео- или адъювантной химиотерапией, в ряде случаев улучшает показатели выживаемости, однако и этот вопрос остается дискутабельным.
Одним из основных вопросов, который приходится решать после радикальной цистэктомии, является отведение мочи.
Уретеросигмостомия была первым типом деривации мочи, который главным образом выполняли в первой половине века. Он был оставлен в 50-е годы, главным образом из-за развития большого количества осложнений, таких как гиперхлорэмический гипокалиемический ацидоз, пиелонефрит и малигнизации толстой кишки. В конце 20 века уретеросигмостомия начала свое возрождение в виде модификаций с формированием резервуаров с низким давлением. Эта несложная операция позволяет избежать наружных собирающих приспособлений и катетеризаций. Как бы то ни было, применение современных антибиотиков, шовного материала, анестезии, усовершенствование хирургической техники, использование профилактического антиацидозного лечения сделали уровень осложнений после этой операции сопоставимым с другими формами удерживающего отведения мочи.
В середине этого века Брикер предложил илеальный кондуит. С тех пор это одна из самых распространенных дериваций мочи. Основными преимуществами этой операции являются простота конструкции, невысокая частота послеоперационных осложнений и большой опыт применения.
В последние два десятилетия 20-го столетия был разработан метод накожного отведения мочи с ее удержанием. В 1908 году Verhoogen в Брюсселе сделал первую попытку использования илеоцекального сегмента для создания резервуара с аппендиксом, служащим для накожного выведения мочи. Gilchrist развил эту идею в 1950 году. Однако только после выдающейся работы Kock и соавторов и их публикации в Journal of Urology по настоящему было начато сражение за континентное отведение мочи.
Таким образом, выделяют три основных варианта деривации мочи после цистэктомии –
1. Наружное отведение (уретерокутанеостомия, нефростомия, создание кишечных резервуаров с формированием “сухих” и “влажных” уростом).
2. Внутреннее отведение в непрерывную кишку (уретеросигмостомия, операция Mainz-pouch 2)
3. Ортотопическая реконструкция мочевого пузыря (операции Studer, Hautman, Padovana и т.д.).
По мнению Н.А. Лопаткина Двусторонняя уретерокутанестомия даже при соблюдении всех правил ее выполнения гарантирует сохранение функции почек лишь на короткое время. Затем, как правило присоединяется или прогрессирует пиелонефрит и надвигается угроза ХПН.
В настоящее время для деривации применяют следующие виды оперативных вмешательств: Индиана, Майнц-пауч 1, Майнц-пауч 2, Studer, Hautman.
Однако наиболее популярным способ деривации мочи после радикальной цистэктомии является операция Брикера. Это самая простая и наименее склонная к осложнениям операция.
Почему при радикальном лечении рака мочевого пузыря получаютя неудовлетворительные результаты, хуже чем, при операциях по поводу опухолей других органов. Чем объяснить это. На наш взгляд операция удаления мочевого пузыря производится поздно, тогда, когда организм больного ослаблен, когда имеются тяжелые осложнения со стороны почек со значительным снижением их функции.
В проблеме цистэктомии существует своеобразный порочный круг ввиду того, что операция эта всегда предлагается и производится поздно, она дает большую смертность и частые осложнения, а эти последние, в свою очередь отпугивают больных и разочаровывают урологов.
Радикальная цистэктомия должна выполняться не как последняя надежда после безуспешных попыток контролировать опухоль с помощью органосохраняющих операций, а как выполняемое по четко установленным показаниям в ранних стадиях рака мочевого пузыря по настоящему радикальное оперативное вмешательство.
Новые исследования в области биологии клетки и тканей, новые научные материалы принесли некоторые новшества в реконструктивную урологию. В будущем, например, может успешно применятся аутотрансплантация уротелиальных и мышечных клеток, поэтому показания для методов отведения мочи могут измениться.
Мы также надеемся, что в ближайшем будущем появление новых малотоксичных препаратов, появление новых методов лечения, в том числе с использование генной инженерии позволит шире шире применять орган-сохраняющие методики в лечении больных раком МП.