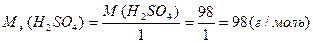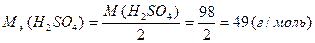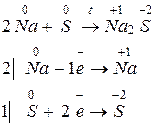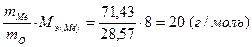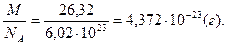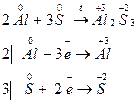Измерение что это в химии
измерение
Смотреть что такое “измерение” в других словарях:
ИЗМЕРЕНИЕ — представление свойств реальных объектов в виде числовой величины, один из важнейших методов эмпирического познания. В самом общем случае величиной называют все то, что может быть больше или меньше, что может быть присуще объекту в большей или… … Философская энциклопедия
Измерение X — Измерение Икс … Википедия
измерение — замер, обмер; вымеривание, установление, фиксирование, замеривание, распознавание, промер, диагностирование, смеривание, нахождение, обмеривание, определение Словарь русских синонимов. измерение см. установление 2 Словарь синонимов … Словарь синонимов
измерение — (в психологии) научный метод представления числами интересующего психического свойства или параметров психического процесса на основе нек рых процедурных правил. Совокупность теоретико математических представлений и процедурных правил,… … Большая психологическая энциклопедия
ИЗМЕРЕНИЕ — ИЗМЕРЕНИЕ, измерения, ср. 1. Действие по гл. измерить измерять. Измерение роста. 2. Измеряемая величина, протяжение (мат.). Куб имеет три измерения: длину, высоту и ширину. ❖ Четвертое измерение (ирон.) перен. сверхъестественная и бесплодно… … Толковый словарь Ушакова
ИЗМЕРЕНИЕ — последовательность эксперим. и вычислит. операций, осуществляемая с целью нахождения значения физ. величины, характеризующей нек рый объект или явление. И. завершается определением степени приближения найденного значения к истинному значению… … Физическая энциклопедия
ИЗМЕРЕНИЕ — ИЗМЕРЕНИЕ, действия, производимые с целью нахождения числовых значений какой либо величины в принятых единицах измерения. Измерение выполняют с помощью соответствующих средств измерения (линейка, часы, весы и т.д.). Различают прямые… … Современная энциклопедия
ИЗМЕРЕНИЕ — совокупность действий, выполняемых при помощи средств измерений с целью нахождения числового значения измеряемой величины в принятых единицах измерения. Различают прямые измерения (напр., измерение длины проградуированной линейкой) и косвенные… … Большой Энциклопедический словарь
измерение — Сравнение конкретного проявления измеряемого свойства (измеряемой величины) со шкалой (частью шкалы) измерений этого свойства (величины) с целью получения результата измерения (значения величины или оценки свойства). [МИ 2365 96] измерение… … Справочник технического переводчика
Измерение — ИЗМЕРЕНИЕ, действия, производимые с целью нахождения числовых значений какой либо величины в принятых единицах измерения. Измерение выполняют с помощью соответствующих средств измерения (линейка, часы, весы и т.д.). Различают прямые… … Иллюстрированный энциклопедический словарь
Тема 2 Измерение вещества



Химия С-12 27.05.2020
1. Изучите материал.
2. Выполните задания после изучения темы.
Массы атомов и молекул очень малы. Например, масса одного из наиболее тяжелых атомов — атома урана составляет 39,54 · 10 −23 г, а масса самого легкого — атома водорода — 1,67 · 10 −24 г. Понятно, что проводить химические расчеты с такими малыми числами очень трудно, поэтому используют не абсолютные массы атомов (в граммах), а относительные массы.
За единицу атомной массы в химии и физике с 1961 г. принята атомная единица массы (а. е. м.), которая равна 1 /12 массы атома изотопа углерода 12 С:
1 а. е. м. = 1 /12 · m( 12 C) = 1 /12 · 1,9927 · 10 −26 кг =
Относительная атомная масса (Аr) химического элемента — это величина, равная отношению средней массы атома (mа) природной смеси изотопов данного элемента к 1 /12 массы атома углерода 12 С.
Например, относительная атомная масса химического элементы серы равна 32
Зная относительную атомную массу, можно найти абсолютную массу атома mа (в граммах, килограммах). Для этого нужно относительную атомную массу умножить на одну атомную единицу массы; например для атома меди получим
Относительная молекулярная масса(Мr)вещества— это величина, равная сумме относительных атомных масс всех атомов, входящих в состав молекулы или формульной единицы вещества.
Например, относительную молекулярную массу молекулы серной кислоты можно рассчитать следующим образом:
= 2 · 1 + 1 · 32 + 4 · 16 = 98.
Для того чтобы найти абсолютную массу молекулы mм (в граммах или килограммах), нужно относительную молекулярную массу умножить на одну атомную единицу массы; для молекулы H2SO4 получим
Важным показателем количественного состава вещества является массовая доля химического элемента в сложном веществе.
Массовую долю w(Х)химического элементаХв сложном веществе рассчитывают по формуле
где n — число атомов элемента Х в молекуле или формульной единице вещества; Ar(Х) — относительная атомная масса элемента Х; Мr — относительная молекулярная масса вещества.
Например, массовые доли химических элементов в серной кислоте составляют: ( H2SO4 )
Массовые доли, как правило, выражают в процентах, для этого долю умножают на 100 %:
w(S) = 0,327 · 100 % = 32,7 %,
w(O) = 0,653 · 100 % = 65,3 %,
Если известны массовые доли химических элементов А, В, С в соединении АxВyСz, то можно вывести молекулярную формулу этого соединения :
В качестве примера выведем формулу вещества, в котором массовая доля калия составляет 24,7 %, марганца — 34,8 %, кислорода — 40,5 %.
В результате получим x = 1, y = 1, z = 4.
Таким образом, формула вещества — КMnO4 (перманганат калия — сильнейший окислитель).
· Количество вещества (ν) — это физическая величина, которая показывает число атомов, молекул или других формульных единиц данного вещества. Единица измерения количества вещества — моль.
· Моль — это такое количество вещества, которое содержит столько атомов, молекул и других формульных единиц, сколько атомов содержится в 0,012 кг углерода 12 С.
Число 6,02 · 10 23 названо постоянной (числом) Авогадро (NA) в честь итальянского ученого А. Авогадро.
В одном моле любого вещества всегда содержится 6,02 · 10 23 атомов, молекул или других формульных единиц данного вещества:
Для измерения количества вещества используют следующие единицы: моль, киломоль (кмоль; 1 кмоль = 10 3 моль), миллимоль (ммоль; 1 ммоль = 10 −3 моль).
Молярная масса (М) — это физическая величина, равная отношению массы вещества (m, г) к количеству вещества (ν, моль):
Единица измерения молярной массы — г/моль.
По сути, молярная масса — это масса 1 моля вещества, поэтому молярную массу можно рассчитать как массу 6,02 · 10 23 атомов (молекул и т. п.):
М = 6,02 · 10 23 моль −1 · ma = 6,02 · 10 23 моль −1 · Ar · 1 а. е. м. =
= 6,02 · 10 23 моль −1 · 1,6606 · 10 −27 кг · Ar = 1 г/моль · Ar.
Аналогично можно получить
Полезно помнить, что численно значения молярной массы и относительной атомной массы или относительной молекулярной массы совпадают.
Молярный объем газа (Vm) — это физическая величина, равная отношению объема газообразного вещества (V, л) к количеству вещества (ν, моль):
Единица измерения молярного объема — л/моль.
В заключение отметим, что количество вещества (ν, моль) можно рассчитать:
· как отношение массы (m) вещества к его молярной массе (M)
· как отношение объема (V) газообразного вещества к молярному объему (Vm) при нормальных условиях (н. у.):
· как отношение числа (N) атомов, молекул или других формульных единиц вещества к постоянной Авогадро (NА):
1. Дайте определения понятий «относительная атомная масса», «относительная молекулярная масса».
2. В чем сходство и различие понятий «масса атома» и «относительная атомная масса»?
3. Как рассчитывают молярную массу вещества? В каких единицах ее выражают?
4. Как рассчитывают молярный объем? В каких единицах его выражают?
5. Как рассчитывают количество вещества? В каких единицах его выражают?
6. Сколько молей составляют: а) 14 г азота; б) 48 г кислорода?
7. Определите массу: а) 0,1 моля NaOH; б) 2 молей HСl.
8. Определите объем: а) 40 г углекислого газа CO2.
9. Какое количество вещества составляют: а) 3,7 г Ca(OH)2?
10. Сколько молекул содержится: а) в 4 кг NaOH?
ОСНОВНЫЕ ПОНЯТИЯ ХИМИИ И ЕДИНИЦЫ ИХ ИЗМЕРЕНИЯ



Количество вещества (n) – это физическая величина, которая характеризует число структурных единиц (атомов, молекул, ионов, электронов, протонов, эквивалентов и др.) в определенной порции вещества.
Единица измерения количества вещества – моль.
Необходимо указывать, к каким структурным единицам относится понятие моль, например, «моль молекул водорода», «моль атомов водорода», «моль ионов водорода», «моль эквивалентов» и др.
Молярная масса – масса 1 моль вещества. Единица измерения г/моль.
Например, М(Н2О) = 18 г/моль, М(NaOH) = 40 г/моль, М(HNO3) = 63 г/моль.
Эквивалент – реальная или условная частица вещества, которая может замещать, присоединять, высвобождать один ион водорода в кислотно-основных или ионообменных реакциях или один электрон в окислительно-восстановительных реакциях.
Молярная масса эквивалентов – физическая величина, измеряемая произведением молярной массы вещества на фактор эквивалентности.
Молярная масса эквивалентов – масса 1 моль эквивалентов, т.е. 6,02·10 23 эквивалентов. Обозначение М(fэкв.Х), М( 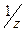
Фактор эквивалентности – число, обозначающее, какая доля реальной частицы вещества Х эквивалентна одному иону водорода в данной кислотно-основной реакции или одному электрону в данной окислительно-восстановительной реакции.
Молярная масса – это абсолютная константа индивидуального вещества, молярная масса эквивалентов – константа вещества в конкретной реакции.
· в окислительно-восстановительной реакции – число электронов, которые отдает или присоединяет частица в данной окислительно-восстановительной реакции.
Ниже приведены формулы для вычисления молярных масс эквивалентов сложных веществ:
| Современные рекомендуемые обозначения физических величин, примеры их записи и расчета | Ранее используемые обозначения физических величин, примеры их записи и расчета |
М( 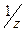 оксида)= оксида)= 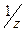 ·М(оксида) М( ·М(оксида) М( 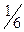 Al2O3)= Al2O3)= 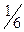 ·102= 17(г/моль) ·102= 17(г/моль) | 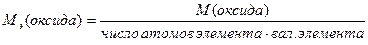 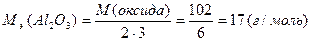 |
М( 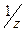 кислоты)= кислоты)= 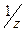 ·М(кислоты) М( ·М(кислоты) М( 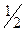 H2SeO4)= H2SeO4)= 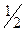 ·145=72,5(г/моль) ·145=72,5(г/моль) | 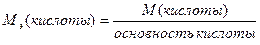 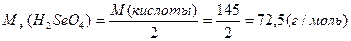 |
М( 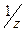 основания)= основания)= 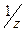 ·М(основания) М( ·М(основания) М( 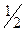 Ca(OH)2)= Ca(OH)2)= 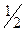 ·74=37(г/моль) ·74=37(г/моль) | 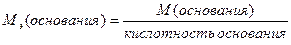 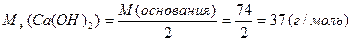 |
М( 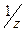 соли)= соли)= 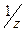 ·М(соли) М( ·М(соли) М( 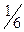 Fe2(SO4)3)= Fe2(SO4)3)= 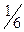 ·400=66,67(г/моль) ·400=66,67(г/моль) | 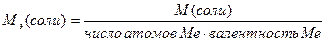 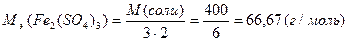 |
Молярная масса эквивалентов одного и того же вещества зависит от течения реакции:
В первом случае молярная масса эквивалентов H2SO4 равна ее молярной массе, во втором – половине молярной массы, так как в первом случае в реакции принимает участие один ион водорода (основность равна 1, fэкв= 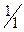
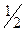
М( 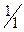

М( 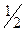
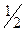

Для определения фактора эквивалентности и молярной массы эквивалента вещества в окислительно-восстановительной реакции необходимо написать уравнение реакции и электронный баланс реакции.
Например, для реакции взаимодействия натрия и серы запишем уравнение реакции и электронный баланс:
Каждый атом натрия отдает один электрон, а каждый атом серы принимает два электрона. Поэтому
Молярная масса эквивалента равна произведению фактора эквивалентности на молярную массу вещества:
Ar (Na) = 23, M(Na) = 23 г/моль, Мэкв(Na) = (1/1)·23 = 23 (г/моль);
Ar (S) = 32, M (S) = 32 г/моль, Мэкв(S) = (1/2)·32 = 16 (г/моль).
Закон эквивалентов.
Закон эквивалентов дает количественное соотношение между массами вступающих во взаимодействие реагентов или связанных в химических соединениях элементов.
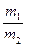
Из последнего соотношения следует:
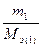
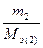
т.е. число моль эквивалентов вступающих в реакцию или образующихся в результате реакции веществ равны между собой:
Количественным выражением закона эквивалентов для реакций, протекающих в растворах, является соотношение:
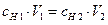
где сн – нормальная концентрация вещества (молярная концентрация эквивалента).
Примеры решения типовых задач.
Пример 1. Расчет количества вещества по числу структурных единиц.
Задача 1. Какое количество вещества гидроксида меди (II) содержит 1,505·10 23 атомов водорода?
Решение. Количество вещества гидроксид-ионов в гидроксиде меди (II), выраженное в моль, составляет:
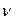
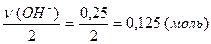
Пример 2.Расчет молярной массы эквивалента элемента по составу химического соединения на основе закона эквивалентов.
Задача 1. Оксид металла содержит 28,57% кислорода. Определите молярную массу эквивалента металла.
Решение. В соответствии с законом эквивалентов массы связанных между собой в химическом соединении металла m(Me)и кислорода m(O) пропорциональны молярным массам их эквивалентов
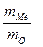
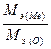
Полагая массу оксида равной 100 г, имеем m(O)=28,57 г и m(Me)=71,43г. Поскольку молярная масса эквивалента кислорода Мэ(О)=8г/моль, из выражения 1 находим молярную массу эквивалента металла:
Мэ(Ме)=
Пример 3.Расчет молярной массы эквивалента вещества по массе и объему участвующих в реакции веществ на основе закона эквивалентов.
Задача 1. 2,14 г металла вытесняют из кислоты 2 л водорода (н.у.). Вычислите молярную массу эквивалента металла.
Решение. Согласно закону эквивалентов количество вещества эквивалентов металла равно количеству вещества эквивалентов водорода
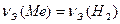
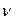
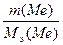
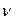
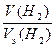
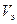
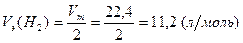
Vm – молярный объем газа при н.у., равный 22,4 л/моль.
Тогда в соответствии с выражениями (2) и (3)
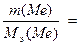
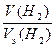
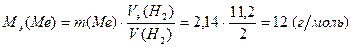
Пример 4.Расчет молярной массы эквивалента элемента по соотношению масс реагента и продукта реакции на основе закона эквивалентов.
Задача 1. Из 3,85 г нитрата металла получено 1,6 г его гидроксида. Вычислите молярную массу эквивалента металла.
Решение. В соответствии с законом эквивалентов соотношение масс нитрата и гидроксида металла равно
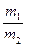
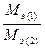
Молярные массы эквивалентов нитрата и гидроксида металла равны
Подставляя эти выражения в уравнение (4) имеем
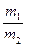
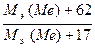
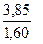
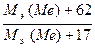
Решая последнее уравнение относительно Mэ(Me), имеем
Пример 5.Определение молекулярной массы газообразного вещества на основе его плотности.
Задача 1. Масса 1 л газа при н.у. равна 1,175 г. Вычислите молекулярную массу газа и массу одной молекулы газа.
Решение. Поскольку один моль газа при нормальных условиях занимает объем 22,4 л, его молярная масса равна
М(газа) = 1,175·22,4 = 26,32 (г/моль).
Поскольку в 1 моль любого вещества содержится 6,02·10 23 молекул, масса одной молекулы определяется по формуле
m=
Пример 6.Определение фактора эквивалентности и молярной массы эквивалента вещества в окислительно-восстановительной реакции.
Задача 1. При взаимодействии алюминия и серы образуется сульфид алюминия. Вычислите факторы эквивалентности и молярные массы эквивалентов алюминия и серы.
Решение. Фактор эквивалентности – это число, обозначающее, какая доля реальной частицы вещества эквивалентна одному иону водорода в кислотно-основной реакции или одному электрону в окислительно-восстановительной реакции.
Реакция взаимодействия алюминия и серы протекает согласно уравнению:
Каждый атом алюминия отдает три электрона, а каждый атом серы принимает два электрона. Поэтому
Молярная масса эквивалента вещества – это масса вещества, эквивалентная 1 моль ионов водорода в кислотно-основной реакции или 1 моль электронов в окислительно-восстановительной реакции. Молярная масса эквивалента равна произведению фактора эквивалентности на молярную массу вещества:
Ar (Al) = 27; M(Al) = 27 г/моль; Мэкв (Al) = 1/3·27 = 9 г/моль;
Ar (S) = 32; M(S) = 32 г/моль; Мэкв(S) = 1/2·32 = 16 г/моль.