какие вирусы встраиваются в днк человека
Сколько вирусов в нашей ДНК
Число спящих вирусных последовательностей в геноме человека увеличилось более чем вдвое.
Давно не секрет, что многие последовательности в человеческом геноме в прошлом были вирусами, которые когда-то пришли «в гости» к нашим далёким предкам, да так «в гостях» и остались. Вирусы эти относятся к группе ретровирусов, к которым принадлежит, например, современный вирус СПИДа, и в ДНК они проникали, вероятно, с помощью того же механизма, что и их нынешние родственники.
Гены ретровирусов записаны в молекулу РНК, именно она находится в белковой оболочке вирусной частицы, и, когда РНК попадает в клетку, то специальные вирусные белки снимают с неё ДНК-копию. Затем ДНК-копия встраивается в клеточную хромосому, и теперь всё, что клетка делает со своими генами, она будет проделывать и с вирусными. На вирусном участке ДНК клеточные белки синтезируют много РНК, которые, в свою очередь, служат шаблонами для производства вирусных белков. Всё заканчивается тем, что РНК упаковывается в вирусные частицы, которые выходят наружу.
Но бывает так, что клетка подавляет синтез вирусных РНК, так что вирус, встроившись в ДНК хозяина, теряет способность размножаться. (Да и сам встроенный в клеточную ДНК вирус может на время «уснуть», не вредя хозяину.) Так или иначе, вирусный геном становится пассивным грузом, переходящим от родительской клетки к дочерней. И если проанализировать, например, геном млекопитающих, то можно обнаружить множество ретровирусных последовательностей, которые в большинстве своём неактивны – после того, как клетки запрещают синтезировать на них РНК, они ещё и многократно мутируют, так что, в конце концов, становятся совершенно безопасным и неактивным генетическим мусором.
Вирусные последовательности, которые осели в человеческой ДНК, называют HERV – human endogenous retroviruses, или эндогенные ретровирусы человека. Считается, что на их долю приходится 8% генома, однако далеко не все из них описаны – тут нужно учитывать, что один и тот же вирус мог попасть в несколько мест в ДНК, кроме того, из-за мутаций и генетических перестроек вирусные гены могли измениться довольно сильно.
До сих пор было достоверно известно о семнадцати вирусных фрагментах (здесь стоит говорить именно о фрагментах, а не о генах, так как фрагмент может объединять несколько генов, к тому же необязательно хорошо сохранившихся). В статье в PNAS, которую опубликовали исследователи из Мичиганского университета и Университета Тафтса, к этим семнадцати добавляется ещё девятнадцать. Джон Коффин (John Coffin) и его коллеги проанализировали 2 500 геномов со всего света, причем особое внимание уделялось африканским ДНК – поскольку люди когда-то начали расселяться по миру именно из Африки, то и вероятность того, что здесь, в местных популяциях следы вирусных гостей будут встречаться чаще.
Действительно, с помощью сложнейших математических и статистических методов удалось обнаружить, что в африканских геномах следов HERV заметно больше, чем в азиатских, американских или европейских. Как и ожидалось, большая часть вирусов была изрядно побита жизнью и эволюцией – изменения, которые произошли с их последовательностями, сделали невозможной запуск вирусной программы. За одним исключением: у 50 людей в Х-хромосомах нашли последовательность, названную Xq21, и это был полный вирусный геном, в котором сохранились все гены, необходимые для собственного размножения. Однако может ли Xq21 и впрямь проявлять какую-то активность, пока непонятно. Стоит добавить, что Xq21 – всего лишь второй полноценный спящий вирус, обнаруженный в человеческой ДНК.
Возможно, эти семнадцать плюс девятнадцать – не все вирусные последовательности, которые задержались в человеческом геноме; просто искать их, как мы сказали, довольно сложно, в частности ещё и потому, что не все вирусы есть у всех людей, тот же Xq21 нашли только у 50 из 2 500. Считается, что такие вирусные фрагменты, оказавшись рядом с некоторыми генами, могут менять их активность и тем самым провоцировать разные болезни, вплоть до рака.
Однако от «домашних вирусов» есть и польза. Так, год назад мы рассказывали о том, как они защищают человеческий эмбрион от инфекции. А немногим ранее мы говорили о работе исследователей из Юго-западного медицинского центра Университета Техаса, которые обнаружили, как эндоретровирусы помогают иммунитету: оказалось, что они стимулируют в ДНК иммунных клеток синтез антител в ответ на появления в организме чужеродных молекул.
Какие вирусы встраиваются в днк человека
Добавить в закладки
Вы сможете увидеть эту публикацию в личном кабинете
Добавить в закладки
Вы сможете увидеть эту публикацию в личном кабинете
Добавить в закладки
Вы сможете увидеть эту публикацию в личном кабинете
Добавить в закладки
Вы сможете увидеть эту публикацию в личном кабинете
Добавить в закладки
Вы сможете увидеть эту публикацию в личном кабинете
Добавить в закладки
Вы сможете увидеть эту публикацию в личном кабинете
Добавить в закладки
Вы сможете увидеть эту публикацию в личном кабинете
Добавить в закладки
Вы сможете увидеть эту публикацию в личном кабинете
Добавить в закладки
Вы сможете увидеть эту публикацию в личном кабинете
Подпишитесь на нашу рассылку и получайте новости о последних проектах, мероприятиях и материалах ПостНауки
Может ли вакцина или вирус встроиться в геном человека и навредить ему?
Любая прививка должна выполнять задачу формирования иммунитета для борьбы с опасной инфекцией. Однако если раньше вакцины состояли из мертвых или ослабленных микроорганизмов, то самые новые противовирусные вакцины – это сложные продукты генной инженерии.
Генетика – это наука, которая у многих людей вызывает опасения и недоверие. Сегодня мы расскажем, как на самом деле работают новейшие генные вакцины, о которых так много говорят, и могут ли они изменить ДНК человека. А также мы познакомим Вас с существом, которое действительно меняет наш генетический код.
Как в массовом сознании возникла идея возможности изменения ДНК человека путем инъекции? Все началось с фильмов о зомби-апокалипсисе и комиксов о супергероях.
История человека-паука с точки зрения науки
Многие смотрели фильм про человека-паука, который начинается с того, что студента кусает генно-модифицированный паук. После этого гены паука встроились в ДНК человека, и обычный парень получил сверхспособности – научился лазать по стенам и выпускать паутину.
Зато в новейших вакцинах есть молекулы генетического кода вируса. Давайте рассмотрим две самые передовые вакцины, о которых сегодня можно услышать из каждого утюга.
Векторная вакцина
Огромное преимущество этой вакцины в том, что человеку вводят не сам опасный вирус, как это делалось раньше, а лишь маленький кусочек его генетического кода. Таким образом, вероятность заражения и тяжелых побочных эффектов практически отсутствует.
Но сам по себе этот фрагмент вирусного гена не может попасть в клетку. Поэтому его доставляют с помощью вектора.
Вектор – это другой вирус, который выполняет роль доставщика. И лучше всего с этой ролью справляется обыкновенный аденовирус, который вызывает простуду.
В процессе изготовления вакцины ДНК аденовируса подвергается двум изменениям:
После введения вакцины аденовирус проникает в клетки человека, высвобождая внутри клеточного ядра свою ДНК. Эта ДНК не может копировать сама себя и вызвать инфекцию. Вместо этого она превращает клетку в нано-фабрику по производству шипов опасного вируса.
Важно!
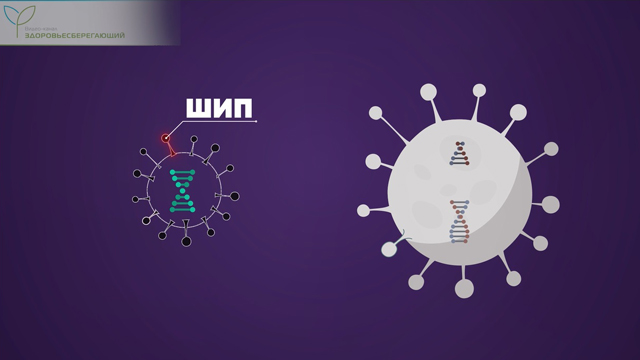
Шипы вируса в отсутствие самой вирусной частицы совершенно безвредны для человека.
Произведенные вирусные шипы выступают на поверхности клетки, а наш иммунитет, распознав в них чужеродный элемент, немедленно блокирует зараженную клетку и вырабатывает антитела к незнакомому белку.
Может ли аденовирусный вектор повредить ДНК человека?
По сути, аденовирусный вектор мало чем отличается от обычного аденовируса, которым в течение жизни заражаются практически все люди на Земле. А манипуляции с ДНК принципиально не меняют его поведение.
По словам Линды Кофлан, исследователя векторных вакцин из Университета Мэрилэнда, аденовирус не имеет ферментативного механизма для присоединения к человеческой ДНК. Дело в том, что две молекулы ДНК не могут объединиться сами по себе, без специального фермента. Аденовирус не обладает таким ферментом и полностью безопасен для генома человека. Именно этим обстоятельством руководствовались разработчики вакцины, выбрав аденовирус в качестве “доставщика”.
А учитывая, что вектор лишен способности размножаться, в момент гибели зараженной клетки ДНК вектора поглощается и расщепляется нашими иммунными клетками. Вакцина исчезает без следа, а человек приобретает иммунитет к опасному вирусу, с которым может столкнуться в будущем.
Грегори Поланд, доктор медицинских наук из клиники Мэйо, обратил внимание на то, что изготовители вакцин всегда используют специальные культуры аденовирусов, которые классифицируются как неинтегрирующиеся. Это значит, что безопасность данных векторов для ДНК человека и животных была доказана многократными исследованиями.
Интересный факт!
По мнению ученых, именно векторные вакцины в будущем могут навсегда избавить человечество от рака и ВИЧ-инфекции.
РНК-вакцина
Чтобы понять, как она работает, необходимо знать, что такое матричная РНК.
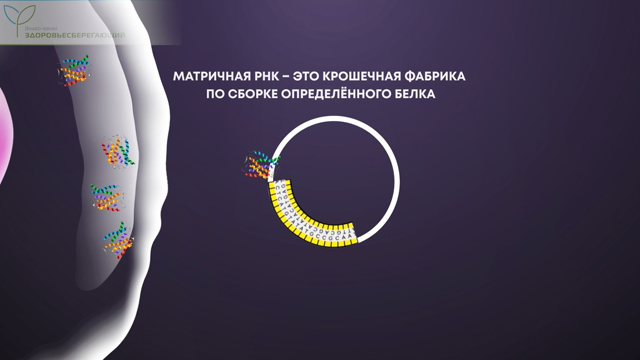
Главным компонентом таких вакцин служит матричная РНК. Эта информационная молекула является копией небольшого участка ДНК. Каждая наша клетка непрерывно создает большое количество таких информационных молекул. По сути, матричная РНК – это крошечная фабрика по сборке определенного белка, необходимого клетке. Каждый вид матричной РНК способен собирать только один вид белка.
Но когда вирус проникает в человеческую клетку, его геном производит свои собственные, вирусные фабрики, которые используют ресурсы клетки для сборки новых вирусов. Именно матричная РНК собирает те самые шипы вируса, которыми он вскрывает клеточную стенку.
Как действует РНК-вакцина?
Цель генетиков – внедрить в наши клетки матричную РНК, создающую вирусные шипы. Причем ученые создают эту молекулу искусственно, буквально собирают по крупицам, окружая каждую РНК специальной липидной оболочкой.
Благодаря липидной оболочке матричная РНК попадает в наши клетки и начинает активно производить вирусные шипы.
Далее события развиваются так же, как в случае с векторной вакциной – вирусные шипы выступают на поверхности клетки, и на них реагирует наша иммунная система.
Преимущества такого метода вакцинации огромны:
Однако есть и недостатки:
Могут ли РНК-вакцины изменить ДНК человека?
1. Матричные РНК – это естественные информационные молекулы, способные только собирать белки. Каждая такая молекула существуют всего 72 часа, после чего она распадается на части.
2. ДНК – это длинная двуцепочечная молекула, а матричная РНК состоит из одной короткой цепочки. По своей структуре матричная РНК сильно отличается от ДНК и даже теоретически не может соединиться с этой более сложной молекулой.
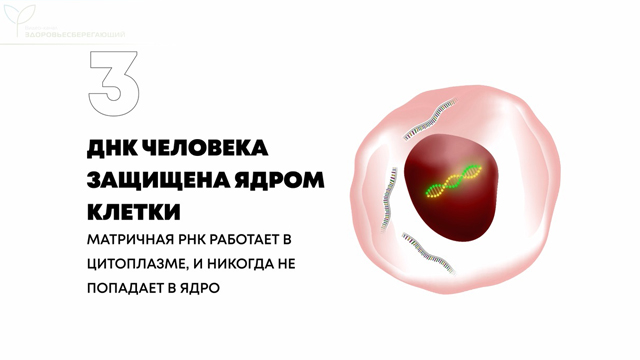
3. ДНК человека защищена ядром клетки. А матричная РНК работает в цитоплазме и никогда не попадает в ядро.
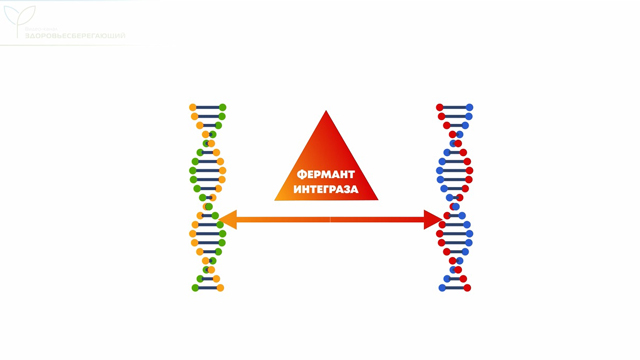
Завершая разговор о вакцинах, хотим отметить, что единственная возможность для изменения человеческой ДНК – это использование в составе вакцин фермента интегразы, способного объединить две молекулы ДНК в одну. Но производители не используют этот фермент при изготовлении вакцин. Зато этим ферментом обладает существо, которое живет с нами рядом уже миллионы лет.
Что вирус может сделать с нашей ДНК?
Итак, вирус действительно способен изменить ДНК человеческой клетки. Но далеко не каждый! Такой способностью обладают только ретровирусы.
Это семейство вирусов обладает особым ферментом – “интегразой”. Этот фермент буквально приклеивает вирусный геном к ДНК человека, подчиняя себе клетку и заставляя ее создавать новые ретровирусы.
В большинстве случаев зараженная клетка с испорченным ДНК погибает. Однако в редких случаях ретровирус заражает сперматозоид или яйцеклетку. И если происходит оплодотворение с участием зараженной клетки, то абсолютно все клетки эмбриона будут содержать вирусную ДНК. Фактически, этот вирус способен создавать мутантов.
К счастью, это происходит крайне редко. Последний раз ретровирус изменил геном человека более 100 тысяч лет назад. Однако за время эволюции это происходило много раз, поэтому ДНК человека на целых 8% состоит из кусочков ДНК древних ретровирусов, которые заражали половые клетки наших предков.
Ученые утверждают, что ретровирусы являются мощным двигателем эволюции. Например, именно благодаря встрече с ретровирусом у предка всех млекопитающих, жившего 160 миллионов лет назад, появился такой важный орган как плацента.
Интересный факт!
Ретровирус может быть как относительно безопасным, так и смертельным. Самым опасным ретровирусом для человека является ВИЧ.
Почему люди относятся с подозрением к новым вакцинам?
Вакцины, созданные методами генной инженерии, совсем недавно вошли в нашу жизнь, но пока не известен ни один случай генных мутаций, связанных с вакцинацией. Однако люди склонны опасаться нового и неизвестного и поэтому часто верят в нелепые теории заговора о массовом чипировании или планах мирового правительства по снижению населения Земли. Как правило, лица, распространяющие подобные теории, имеют весьма приблизительное представление о том, как работают современные вакцины. Покажите им эту статью – возможно, этим Вы кому-то спасете жизнь.
Вирусные геномы в системе эволюции
Человеческая Т-клетка (синий), атакованная ВИЧ (желтый). Вирус ориентирован на Т-клетки, которые играют важную роль в иммунной реакции организма против вторжений, таких как бактерии и вирусы.
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Изучение виромов (популяций вирусов, объединенных общей средой обитания) практикуется в современной вирусологии всё чаще. Подобный подход приносит неожиданные результаты — концентрация вирусов в природе, оказывается, чрезвычайно высока. Например, в морской среде количество вирусных частиц превосходит количество клеток в разы. При этом вирусные частицы способны к передаче генетической информации. Исследования, опубликованные в 2010 году, показали, что агенты переноса генов (АПГ, особая разновидность вирусоподобных частиц, участвующих в горизонтальном переносе генов) привносят в геном бактерий новые фрагменты значительно чаще, чем считалось ранее. А если вирусные частицы настолько распространены в биосфере, и большая часть из них способна к переносу генов, то важно рассмотреть вирусы в рамках общей модели эволюции.
Конкурс «био/мол/текст»-2014
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2014 в номинации «Биоинформатика и молекулярная эволюция».
Главный спонсор конкурса — дальновидная компания «Генотек».
Конкурс поддержан ОАО «РВК».
Спонсором номинации «Биоинформатика» является Институт биоинформатики.
Спонсором приза зрительских симпатий выступила фирма Helicon.
Свой приз также вручает Фонд поддержки передовых биотехнологий.
Вопрос о происхождении вирусов
Существует три основные теории возникновения вирусов:
Однако фундаментальные достижения, такие как открытие рибозимов (молекул РНК, обладающих каталитическим действием), разработка гипотезы о «мире РНК» [2], открытие новых форм вирусов и успехи в геномике делают наименее популярную в прошлом гипотезу доклеточного происхождения все более весомой. И то, что некоторые вирусные белки не обнаруживают гомологии с белками бактерий, архей и эукариот [3], свидетельствует о сравнительно давнем обособлении этой группы. В остальном же достоверно объяснить происхождение вирусов на основании трёх закрепившихся классических гипотез пока еще не вполне удаётся.
Зарождение жизни. Идея последнего универсального общего предка: каким он мог бы быть и что ему предшествовало?
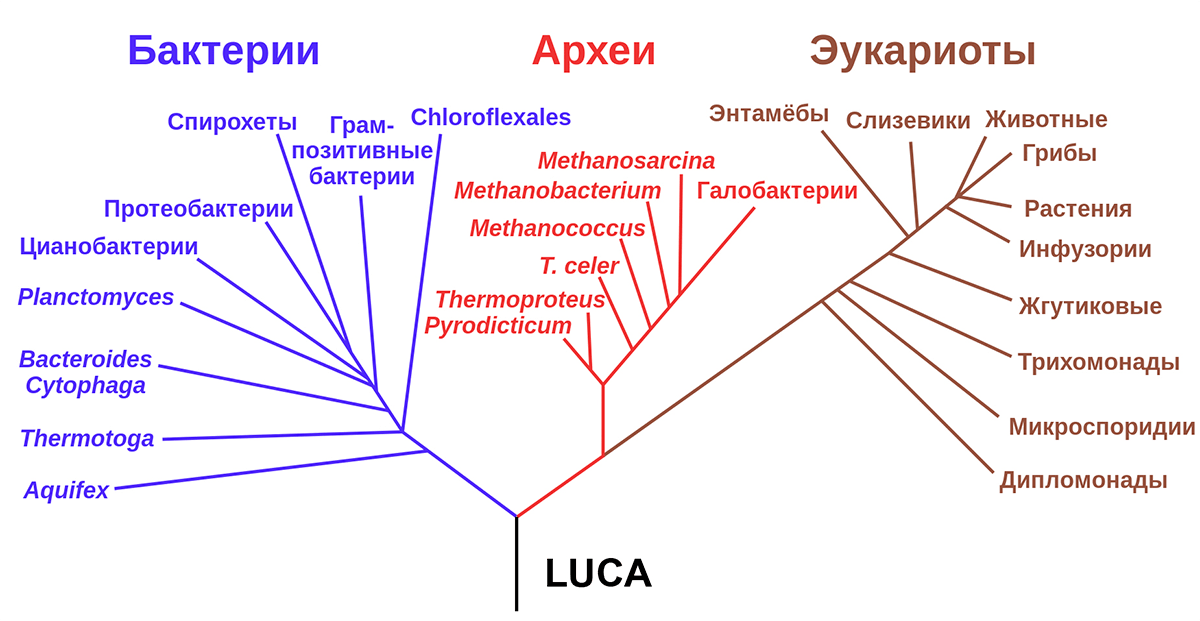
Как известно, концепцию трехдоменной классификации организмов предложил Карл Вёзе [4] в 1977 году, разделив современный биологический мир на три домена — бактерии, археи и эукариоты. Обычно ее представляют в виде дерева с тремя «ветвями», имеющими общий «ствол» (рис. 1). Подобные взгляды были близки еще Дарвину, который видел в подобной концепции логичное завершение своей теории. Так появился термин «Последний универсальный общий предок» (англ. last universal common ancestor, LUCA) — ближайший общий предок всех ныне живущих на Земле живых организмов.
Некоторые ученые считают, что можно выделить и четвертый домен жизни: «Гигантские вирусы: 4-й домен жизни?» [5]. — Ред.
Рисунок 1. Схема трехдоменной классификации, предложенная Вёзе. В основании этой схемы должен находиться последний универсальный общий предок (англ. last universal common ancestor, LUCA).
Самый сильный аргумент в пользу существования LUCA — сохранившаяся общая система экспрессии генов (передачи наследственной информации от гена с образованием РНК или белков), одинаковая для всех живущих организмов. Все известные клеточные формы жизни используют один и тот же генетический код из 20 универсальных аминокислот и стоп-сигналов, закодированных в 64 кодонах (единицах генетического кода). Трансляция генетической информации в процессе синтеза белков по заданной матрице выполняется рибосомами, состоящими из трех универсальных молекул РНК и примерно 50 белков, из которых 20 так же одинаковы для всех организмов.
В 2010 году американский биохимик Даглас Теобальд математически проверил вероятность существования LUCA [6]. Он выбрал 23 белка, встречающихся у организмов из всех трех доменов, но имеющих разную структуру у различных видов. И исследовал эти белки у 12 различных видов (по четыре из каждого домена), после чего использовал компьютерное моделирование различных эволюционных сценариев, чтобы понять, при каком из них наблюдаемая картина будет наиболее вероятной. Оказалось, что концепция, включающая существование универсального предка, значительно вероятнее концепций, где его нет. Еще более вероятна модель, основанная на существовании общего предка, но допускающая обмен генами между видами [7].
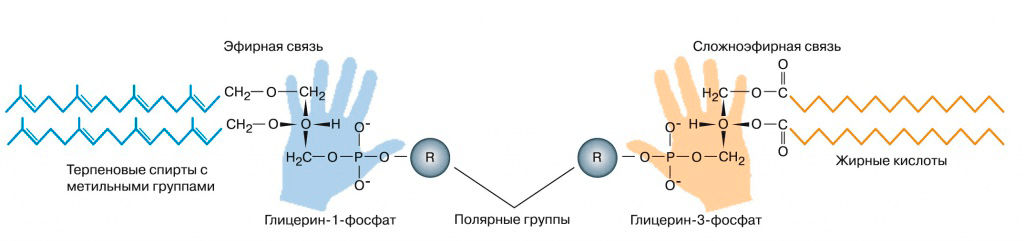
Предположение о том, что LUCA был прокариотической клеткой, похожей на современные, часто принимается по умолчанию. Однако мембраны архей и бактерий имеют разное строение (рис. 2). Получается, что общий предок должен был обладать комбинаторной мембраной. Новая информация о мембранах LUCA появилась в 2012 году, когда несколько групп ученых подробно проанализировали историю генов всех ферментов биосинтеза компонентов липидов у бактерий, архей и эукариот [8].
Рисунок 2. Строение мембранных липидов бактерий (справа) и архей (слева)
Родственными у архей и бактерий оказались ферменты для синтеза терпеновых спиртов и пришивания полярных голов к спиртам. Значит, эти реакции мог проводить и LUCA. Проще всего было предположить, что липиды LUCA состояли из одного остатка терпенового спирта, остатка фосфата и полярной группы (серина или инозитола). Подобные липиды были синтезированы искусственно. Образующиеся из них мембраны обладают высокой подвижностью по сравнению с современными мембранами, хорошо пропускают ионы металлов и малые органические молекулы. Это могло позволять древним протоклеткам поглощать готовую органику из внешней среды даже без транспортных белков.
Реконструкции LUCA методами сравнительной геномики указывают на то, что это должен быть сложный организм без обширного ДНК-генома (геном, состоящий из нескольких сотен РНК-сегментов или ДНК провирусного типа). Но даже если считать возможность существования общего предка доказанной, остается загадкой, в какой среде он мог бы появиться.
«Относительная генетическая сложность могла быть свойственна клеткам еще до появления современного типа клеточной организации — для этого сценария мы будем использовать обозначение LUCAS (рис. 3) (Last Ancestral Universal Common State — последнее универсальное предковое состояние [всего живого]». — пишет биолог Евгений Кунин в своей книге «Логика случая. О природе и происхождении биологической эволюции» [9].
Рисунок 3. Сценарий вирусного мира в гипотезе доклеточного происхождения вирусов подпись
Предполагается, что идеальные условия для формирования жизни существовали вблизи термальных геоисточников (морских или наземных) в виде сети неорганических ячеек, обеспечивающих градиенты температуры и рН, способствующих первичным реакциям, и предоставляющих универсальные каталитические поверхности для примитивной биохимии [10].
Эти отсеки могли быть населены разнородной популяцией генетических элементов. Вначале сегментами РНК. Затем более крупными и сложными молекулами РНК (один или несколько белок-кодирующих генов). А позднее и сегментами ДНК, которые постепенно увеличивались (рис. 3).
Такие простейшие генетические системы использовали неорганические соединения из раствора и продукты деятельности других генетических систем. Сначала они должны были подчиняться индивидуальному отбору ввиду большого разнообразия. Но ясно, что важным фактором такого отбора была способность передавать генетическую информацию, то есть, копировать себя. Присутствие одновременно в одной ячейке молекул, способных копировать РНК, кодировать полезные белки и управлять синтезом новых молекул, давало больше шансов выживать в каждой отдельной ячейке. И в такой системе рано или поздно должны были появиться паразитирующие элементы. А если это так, то вирусные элементы стоят у самых истоков эволюции [11].
Возникновение паразитов — неизбежное последствие эволюционного процесса
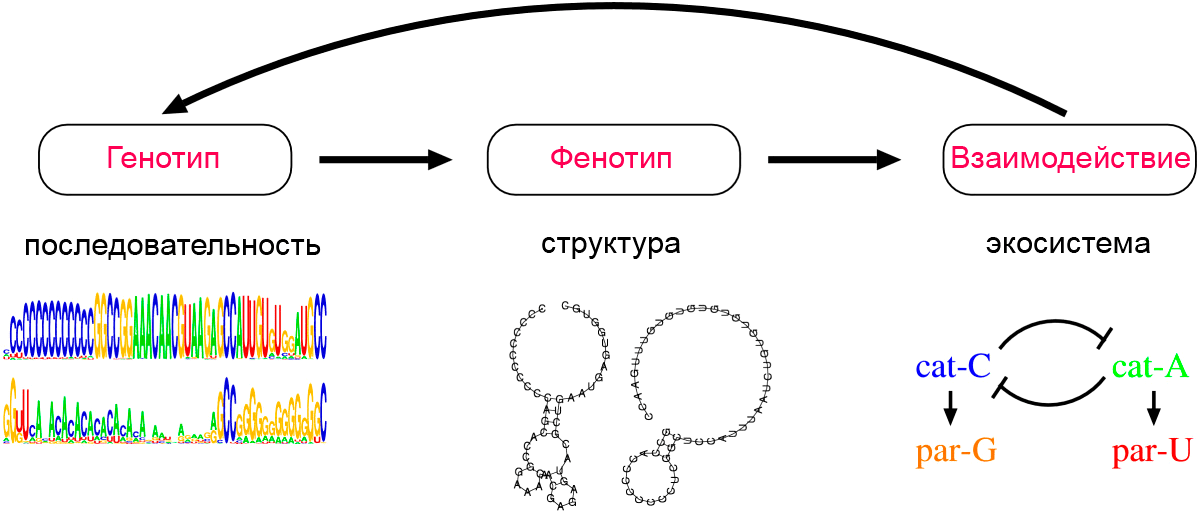
Если рассматривать эволюцию как единый процесс, становится понятно, что виды никогда не эволюционируют независимо друг от друга. Более того, паразиты появляются и в компьютерных моделях эволюции простых репликаторов (самовоспроизводящихся РНК-подобных систем) [9]. Так исследования, проведенные в 2008 году Набуто Такеучи и Паулин Хогвег, представляют собой расчет такой репликативной системы [12]. Простота системы позволяет явно смоделировать отображение генотип-фенотип взаимодействий отдельных репликаторов. Результаты показали, что популяция репликаторов, первоначально состоящая из одного генотипа, развивается в сложную экосистему до четырех «видов». В этой диверсификации «виды» эволюционируют путем приобретения уникальных генотипов с отличной экологической функциональностью, причем два из четырех «видов» становятся паразитами, неспособными к самостоятельной репликации.
Анализ диверсификации показывает, что паразитарные репликаторы, которые были придуманы, чтобы дестабилизировать разнообразие репликатора, на самом деле способствуют эволюции разнообразия посредством создания новой «ниши» для каталитических репликаторов (самовоспроизводящихся репликаторов). Это также делает существующую систему репликатора чрезвычайно стабильной при эволюции паразитов, поскольку в такой системе паразиты имеют преимущество репликации на катализаторах.
Дело в том, что репликация катализаторов требует некоторого периода времени, и паразиты, которые не копируют другие молекулы, могут тратить больше времени на репликацию, чем катализаторы. Таким образом, присутствие катализаторов влечет за собой «нишу» для паразитов. В нынешней системе (рис. 4), C-катализатор (cat-C) создает такую нишу, и это позволяет эволюционировать G-паразиту (par-G). Кроме того, как только создается структура C-катализатор-G-паразит, она создает еще один нишу для фенотипа, который может высвободиться из G-паразита. И если такой фенотип приобретает А-катализатор (cat-A), он тоже эволюционирует. Наконец, создание такого альтернативного катализатора создает нишу для фенотипа, который мог бы паразитировать на этом альтернативном катализаторе (par-U).
Рисунок 4. Схематическое представление структуры модели эволюции РНК-подобной системы. На втором этапе цепочки последовательностей начинают соединяться комплементарными связями сами с собой. В результате у двух видов (cat-C и cat-A) возникает вторичная структура молекулы, которая обладает каталитическим свойством. Она ускоряет собственную репликацию (или репликацию несвернувшихся соседей). Два вида при этом приобретают паразитические свойства (par-G и par-U). Пояснения в тексте.
Таким образом, паразитарные репликаторы способствуют эволюции разнообразия, вместо того, чтобы мешать этому разнообразию. Это также делает существующую систему репликатора чрезвычайно стабильной при эволюции паразитов.
Подобную «гонку вооружений» можно наблюдать, если на молекулярном уровне изучить системы «ионный канал — нейротоксин», которые коэволюционируют, видимо, как раз по этому принципу: «Яды — высокоточное оружие: компьютерное исследование природных нейротоксинов» [13]. — Ред.
Механизмы клеточной защиты против вирусов
Прежде чем говорить о механизмах взлома и защиты подробнее, следует отметить, что вирусы в большинстве случаев не имеют цели убивать клетки хозяев, в которые они попали. У них даже нет цели навредить — это невыгодно для самого вируса. Однако если дело обстоит именно так, какова же причина болезней и эпидемий, вызванных вирусами? Ведь часто при заражении вирусной инфекцией клетка-носитель погибает или становится недееспособной. Конечно, попадая в клетку, вирус перенаправляет ресурсы клетки на свои нужды. Многие вирусы запрещают экспрессию генов клетки-хозяина, что играет главную роль в способности вируса вызывать болезнь. Но наибольший вред исходит от нерасчетливых защитных действий хозяев. А также от противозащитной активности вирусов, не связанных напрямую с механизмами вирусной репродукции. Другими словами, основной вред оказывает не размножение вируса как таковое, а противоборство клеточной защиты и постоянно меняющейся вирусной противозащиты. Само присутствие вируса не всегда сказывается на функциональной работе клетки [14], [15]. Например, в фитопаталогии (науке о болезнях растений) существует термин «толерантность» — патогенный вирус может активно размножаться в растении, не вызывая болезненных проявлений.
Механизмы защиты от вирусов стандартны, поскольку все вирусы уникальны, и приспособиться к каждому не представляется возможным. Это такие механизмы как:
Получается, что клетка борется с вирусом, нарушая собственные обмен веществ и/или структуру. Защитные реакции клетки — это в основном самоповреждающие механизмы.
Вирус заражает конкретную клетку потому, что его механизмы нападения направлены именно против данного типа клеток. Это такие механизмы как:
Схемы защитных приемов клетки и противозащиты вирусов во многом идентичны. Вирусы и клетки применяют одни и те же приемы. Для подавления синтеза вирусных белков клетка использует интерферон, а чтобы подавить образование интерферона, вирус угнетает синтез белков.
Поскольку узнавание вируса неспецифическое, клетка не может знать намерения конкретного вируса. Она может бороться с вирусом лишь стандартными приемами, поэтому ее оборонные действия часто могут быть чрезмерными.
«Можно сказать, что человек, умерший от полиомиелита, погибает от того, что его организм слишком сильно боролся с вирусом. Будь он аккуратнее в этой борьбе, вероятно, выжил бы», — вот слова прославленного русского вирусолога В.И. Агола.
Понятие о вирусном геноме, типы вирусных генов, концепция генов-сигнатур
В исследовании, проведенном вирусологом Евгением Куниным и его коллегами [16], анализ последовательностей вирусных геномов выявил несколько категорий вирусных генов, принципиально отличающихся по происхождению. Можно обсуждать, какая степень дробности классификации оптимальна, но четко различаются пять классов, укладывающихся в две более крупные категории.
Гены с четко опознаваемыми гомологами у клеточных форм жизни:
Вирусные сигнатуры — это гены, общие для многих разнообразных групп вирусов, имеющие лишь отдаленные гомологи у клеточных организмов, для которых имеются убедительные свидетельства в пользу монофилии (общего происхождения) всех вирусных членов соответствующих семейств генов [9]. Фактически эти гены являются признаками «вирусного состояния». Гены-сигнатуры предшествуют клеткам и происходят непосредственно из первичного, доклеточного пула генов.
Таким образом, отличительные особенности генов-сигнатур:
Из всего вышесказанного следует, что эти гены переходили от вируса к вирусу (или к элементу, подобному вирусу) на протяжении четырех миллиардов лет эволюции жизни, а вирусные геномы появились благодаря перемешиванию и подгонке друг к другу генов в гигантской генетической сети, которую представляет собой мир вирусов. Многочисленные гены клеточных форм жизни также пронизывают эту сеть, прежде всего благодаря геномам крупных вирусов, таких как NCDLV и крупным бактериофагам, которые позаимствовали множество генов от своих хозяев на разных этапах эволюции. Однако большинство заимствованных генов сами по себе не критичны для репликации и экспрессии вирусного генома (исключая некоторые случаи возможного неортологичного замещения генов-сигнатур); обычно эти гены участвуют во взаимодействии между вирусом и хозяином. Таким образом, несмотря на интенсивный взаимообмен генами с хозяевами, вирусы всегда происходят от других вирусов.
Вирусы, встроенные в геном, и горизонтальный перенос генов
В процессе эволюции многие вирусы встроились в геномы клеточных форм жизни путем горизонтального переноса генов (ГПГ). Впервые горизонтальный перенос был описан в 1959 году, когда ученые продемонстрировали передачу резистентности к антибиотикам между разными видами бактерий. В 1999 году Рави Джайн, Мария Ривера и Джеймс Лейк в своей статье писали о произошедшей значительной передаче генов между прокариотами [17]. Этот процесс, по-видимому, оказал некоторое влияние также и на одноклеточные эукариоты. В 2004 году Карл Вёзе опубликовал статью, в которой утверждал, что между древними группами живых организмов происходил массивный перенос генетической информации. В древнейшие времена преобладал процесс, который он называет горизонтальным переносом генов. Причем, чем дальше в прошлое, тем это преобладание сильнее [18].
Современные же данные показывают, что ГПГ имеет огромное влияние не только на эволюцию простейших, но и на эволюцию многоклеточных. Молекулярный биолог Петер Гогартен описал горизонтальную генную передачу как «новую парадигму биологии».
Горизонтальный перенос генов — процесс, в котором организм передаёт генетический материал другому организму, не являющемуся его потомком. Горизонтальная передача генов реализуется через различные каналы генетической коммуникации — процессы конъюгации, трансдукции, трансформации, переноса генов в составе плазмидных векторов, вирусов, мобильных генетических элементов (МГЭ).
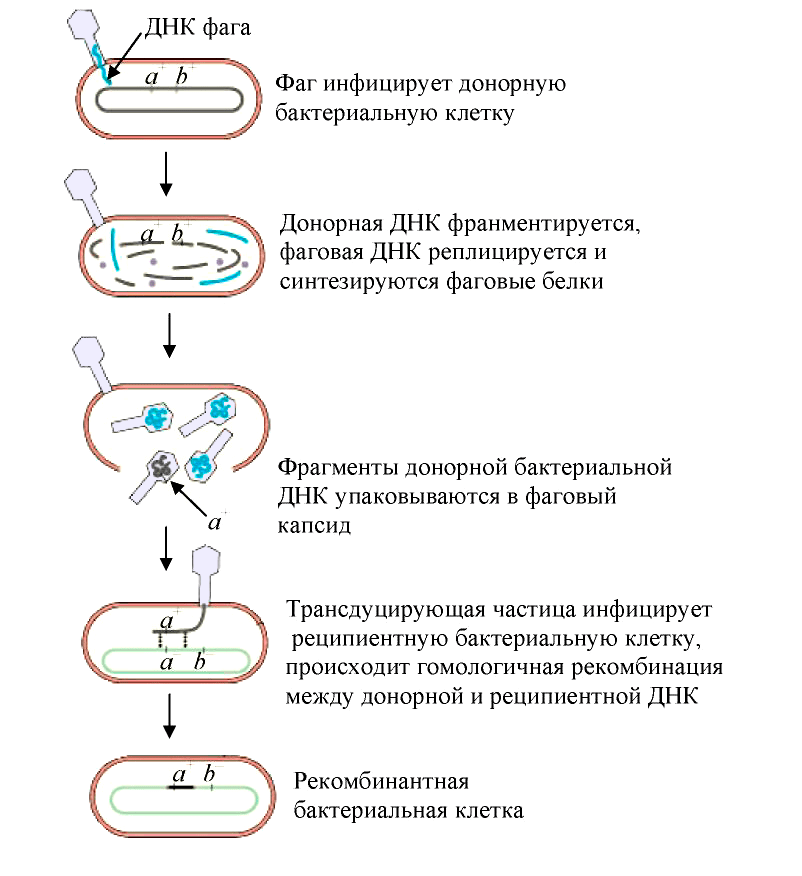
Трансдукция — перенос бактериофагом (агентами переноса генов, АПГ) в заражаемую клетку фрагментов генетического материала клетки, исходно содержавшей бактериофаг [19]. Такой бактериофаг обычно переносит лишь небольшой фрагмент ДНК хозяина от одной клетки (донор) к другой (реципиент). В зависимости от типа трансдукции — неспецифической (общей), специфической или абортивной, геном фага или хозяина-бактерии может быть изменен тем или иным образом:
Рисунок 5. Схема общей трансдукции
Наиболее известным примером специфической трансдукции служит трансдукция, осуществляемая фагом λ. Поскольку этот фаг при переходе в состояние профага включается в хромосому бактерий между генами, кодирующими синтез галактозы и биотина, именно эти гены он может переносить при трансдукции.
Важнейшую роль в эволюции животных играют гены, которые животные заимствуют у вирусов, транспозонов, ретротранспозонов, дельта-ретровирусов (экозогенные и эндогенные вирусы). Фрагменты ДНК вирусов и транспозонов часто «приручаются» высшими организмами и начинают выполнять полезные функции в геноме. Большинство встроенных (ретровирусных, если говорить о высших позвоночных) геномов совершенно бесполезны для хозяина. Фактически идет постоянный процесс превращения так называемой «мусорной» или «эгоистической» ДНК вирусного происхождения в полезные элементы генома. Явление это настолько широко распространено, что для него даже предложен специальный термин — молекулярное одомашнивание [21].
Насколько действительно мусорна мусорная ДНК, обсуждается в статье «Сколько сора в нашей ДНК» [20]. — Ред.
Вот несколько примеров важных эволюционных событий, связанных с молекулярным одомашниванием:
Рисунок 6. Роль гена Peg10 в эмбриональном развитии. Ученые под руководством Рюичи Оно из Токийского медицинского университета Японии показали, что у мышей с выключенным геном Peg10 нарушается развитие плаценты, от чего эмбрион погибает через 10 дней после зачатия [24].
В 2008 году в ходе целенаправленного поиска неиспорченных вирусных генов в геноме человека исследователи нашли два очень похожих друг на друга ретровирусных гена (их назвали ENVV1 и ENVV2), которые, по всей видимости, находятся в рабочем состоянии [25]. Это гены белков оболочки ретровируса. Каждый из них входит в состав своего эндогенного ретровируса (ЭРВ), причем все остальные части этих ЭРВ давно не функционируют.
Авторы нашли гены ENVV1 и ENVV2 и в геномах других приматов: у человекообразных (шимпанзе, орангутана) и других обезьян Старого Света (макаки-резуса, зеленой мартышки), а также у обезьян Нового Света — мармозетки и беличьей обезьяны. Однако у наших более отдаленных родственников (лемуры) этих генов нет. Сопоставив данные по нуклеотидным последовательностям генов ENVV1 и ENVV2 у разных обезьян, исследователи смогли реконструировать эволюционную историю этих генов. В эволюции приматов имело место приобретение полезных генов «со стороны», а именно от ретровирусов. По своему происхождению они являются генами белков оболочки ретровируса [21]. Исходный ретровирус встроился в геном наших предков и стал эндогенным ретровирусом после того, как разделились линии обезьян и лемуров, но до того, как разошлись обезьяны Старого и Нового света, то есть примерно 43–77 млн. лет назад. Этот ЭРВ вскоре подвергся двум последовательным дупликациям, и в результате получилось три одинаковых ЭРВ, расположенных по соседству на одной хромосоме. Все участки этих ЭРВ, кроме генов белков оболочки, стали постепенно дегенерировать. Ген ENVV2 приобрел в результате мутаций какое-то полезное для хозяина свойство и стал сохраняться отбором. Другие два гена, по-видимому, тоже приобрели полезные функции, но они оказались не столь незаменимыми, как ENVV2. Поэтому в некоторых эволюционных линиях обезьян эти гены были утрачены или выведены мутациями из строя. В частности, общий предок человека и шимпанзе потерял ген ENVV3.
Вирусные гены ENVV1 и ENVV2 у человека и обезьян работают в плаценте и, скорее всего, выполняют следующие функции:
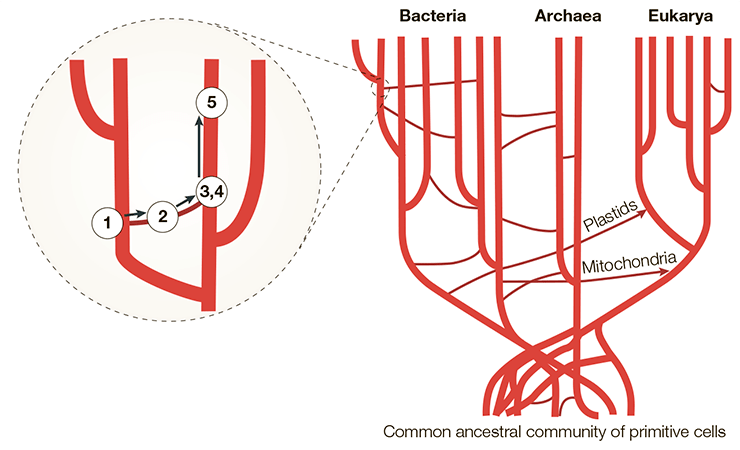
Таким образом, как минимум три полезных применения нашли себе вирусные гены в плаценте приматов. Это показывает, что генетические модификации, которым ретровирусы подвергают организмы, в долгосрочной перспективе могут оказаться полезными или даже определить развитие вида. И с учетом всего вышесказанного древо доменов должно выглядеть как на схеме ниже (рис. 7).
Рисунок 7. Горизонтальный перенос генов в рамках трехдоменного дерева
Заключение
Возникновение паразитов — обязательная черта эволюционирующих систем репликаторов, а соревнование хозяев и паразитов движет эволюцию тех и других. Любой организм является результатом миллионов лет борьбы клеток с невероятно разнообразным миром вирусов. Их действия и их эволюция пронизывают всю историю клеточной эволюции, и сейчас меняется само наше представление о них. Когда-то вирусы считали деградировавшими клетками, но чем больше мы узнаем о вирусах, тем очевиднее, что их роль в общей эволюции значительна. И невероятно много нам еще предстоит узнать.
Статья написана в соавторстве с Евгенией Щепенок.