какие витамины принимать при гемодиализе
Специализированное питание для поддержки пациентов с ХПН
Специализированное питание для поддержки пациентов с хронической почечной недостаточностью
ПОКАЗАНИЯ К ПРИМЕНЕНИЮ
Для специализированного питания пациентов с почечной недостаточностью
ПРОТИВОПОКАЗАНИЯ
Возраст до 3-х лет, галактоземия.
ДОЗИРОВКА И ПРИМЕНЕНИЕ
Для взрослых и детей старше 3-х лет по 2-3 упаковки каждый день.
Пакет ТетраПак 125 мл с трубочкой. Пластиковая бутылка 125 мл с трубочкой.
РЕНИЛОН представлен в двух вкусовых вариантах: абрикос, карамель.
ПРОИЗВЕДЕНО И УПАКОВАНО
Нидерланды. N.V.Nutricia. Zoetermeer. Импортер: ООО «Нутриция Эдванс».
| Состав | Ед.измер. | В 100 мл | В 125 мл |
| Энергетическая ценность | кКал | 200 | 250 |
| Белок | г. | 7,5 | 9,4 |
| Жиры | г. | 10,0 | 12,5 |
| Углеводы | г. | 20 | 25 |
| Натрий (Na) | мг | 59 | 73,7 |
| Калий (K) | мг | 22 | 27,5 |
| Фосфор (Р) | мг | 3,0 | 3,7 |
Калий и фосфор в пищевых продуктах стола №7 Г, которые являются источником белка для пациента с хронической почечной недостаточностью на заместительной терапии.
Мясо, птица, рыба и молочные продукты являются источниками наиболее ценного белка, количество которого имеет важное прогностическое значение для пациентов с хронической почечной недостаточностью, влияя на выживаемость, заболеваемость и уровень реабилитации¹, но в то же время продукты содержащие полноценный белок являются значительным источником фосфора, что может стать причиной гиперфосфатемии, что может приводить к сердечно-сосудистым осложнениям, а также в этих продуктах в достаточном количестве содержится калий, что может привести к гиперкалиемии и внезапной остановке сердца.
Для оценки возможности использования продукта в рационе пациента с хронической почечной недостаточностью существует фосфорно-белковый коэффициент (ФБК=фосфор,мг/белок,г). ФБК в рационе больных с хронической почечной недостаточностью, особенно в диализный период должен как можно меньше. Так как полноценные белковые продукты питания содержат большое количество фосфора и калия, приходится ограничивать их прием в диализный период, ввиду высокого риска развития гиперфосфатемии и гиперкалиемии. В результате ограничения белковых продуктов легко развивается истощение и/или усугубляется уже имеющаяся белково-энергетическая недостаточность.
Перед применением необходима консультация специалиста.
1. Pertosa G., et al. Влияние карнитина на воспалительный процесс пациентов на гемодиализе, 2005
2. Мондоев Л. Г., Бирюкова Л. С. Применение карнитина у больных с хронической почечной недостаточностью, находящихся на лечении программным гемодиализом, 2007
3. Stapleton, et al., 1998
4.Барановский А.Ю. и др. БЭН у больных с терминальной стадией ХПН, корригируемой различными видами заместительной терапии. Нефрология и диализ. Т. 1, 1999 г., №1.
Правила питания
При проведении сеанса диализа часть белка крови остается в диализирующем растворе. Кроме того, усиливаются катаболические процессы. Наконец, сама процедура диализа требует от пациента довольно больших затрат энергии. В этой связи в рационе питания у больных в диализном периоде ХПН должно быть:
меньше натрия (соли);
У больных в диализном периоде ХПН собственные почки обычно почти (а то и вовсе) не выводят натрий (соль) и воду. В промежутках между сеансами лечения натрий накапливается в организме. При накоплении натрия возрастает потребность в приеме жидкости (натрий усиливает жажду), нарастают отеки, повышается артериальное давление. Удалить избыток натрия на диализе можно только за счет ультрафильтрации. Однако ультрафильтрация свыше 2 л жидкости за диализ очень тяжело переносится и может вызвать тяжелые осложнения, например резкую гипотонию (снижение артериального давления), которая может быть еще опаснее, чем артериальная гипертензия. Для того чтобы избежать развития таких тяжелых нарушений, больной с ХПН на диализе должен соблюдать режим потребления воды и соли еще более строго, чем пациент в додиализном периоде. Следует помнить, что для пациента с ХПН, получающего лечение гемодиализом, 2 стакана выпитой жидкости могут быть равны прибавке почти 0,5 кг веса!
С началом лечения диализом количество мочи, как правило, непрерывно падает. Обычно не следует потреблять жидкости больше, чем суточный диурез плюс 500-800 мл жидкости в сутки. Нарастание массы тела между диализами не должно превышать 2-2,5 кг. Желательно равномерно распределять прием жидкости в междиализном : периоде, стремясь к тому, чтобы суточная прибавка веса составляла около 1 кг. При лихорадке, повышении температуры окружающего воздуха пить можно больше, но в этом случае обязательно надо проконсультироваться с врачом.
Напомним, что такие блюда, как супы, подливы, мороженое, сиропы, практически полностью представляют собой жидкости и должны приравниваться к воде. Например, 100 г мороженого = 100 мл воды.
Больным на диализе обычно разрешается прием 6-8 г соли в сутки. Однако зачастую лучше не применять соль вовсе. Вместо нее для улучшения вкусовых качеств можно использовать в небольших количествах специи, пряности, травы, разбавленную горчицу, чеснок, лук, слабый раствор уксуса.
Собственные почки у больных с ХПН на ГД обычно выделяют очень мало или почти не выделяют калий. Весь излишек калия может быть выведен только за счет диализа. Однако значительное накопление калия между диализами крайне опасно, возможна даже остановка сердца. Единственным способом предотвращения развития фатальной гиперкалиемии является строгое соблюдение диетических требований к содержанию калия в рационе. Больной должен практически исключить продукты, богатые калием: сухофрукты (особенно изюм и курагу), цитрусовые, некоторые овощи (особенно картофель в мундире), зелень, соки, орехи, какао, овсяные хлопья, отруби.
Для уменьшения содержания калия (и натрия) в картофеле и других овощах можно очищенные, мелко нарезанные продукты вымачивать в воде в течение 6-10 часов, несколько раз меняя воду. Такая процедура может снизить количество калия в овощах на две трети. В незнакомых продуктах следует оценивать содержание калия по таблицам. В целом обычно нельзя потреблять более 2000 мг калия в сутки.
Картофель, морковь, свеклу, брюкву очищают, нарезают ломтиками толщиной около 3 мм и замачивают в теплой воде по крайней мере на 2 часа. Объем воды для замачивания должен превышать объем овощей в 10 раз. После замачивания овощи промывают и варят в течение 5 минут, при этом объем воды должен в 5 раз превышать объем овощей. Отваренные овощи (можно заранее расфасовать по порциям) замораживают в морозильной камере и затем используют по мере необходимости, предварительно разморозив при комнатной температуре.
Накопление фосфора у пациентов с ХПН, получающих терапию гемодиализом, и развитие гиперфосфатемии (повышение концентрации неорганических соединений фосфора в крови), к сожалению, наблюдается очень часто. Гиперфосфатемия способствует прежде всего нарушениям обмена кальция, повреждениям костей и желез внутренней секреции. Одним из путей предотвращения таких осложнений является потребление продуктов с фосфорно-белковым коэффициентом меньше 20, желательно также избегать продуктов с высоким фосфорно-белковым коэффициентом (например, сыры от 27 до 40).
Усиление катаболических процессов в диализном периоде ХПН кардинально меняет требования к потреблению белка. Диета больных с ХПН на ГД должна быть высокобелковой. Несоблюдение этого правила может вызвать снижение мышечной массы, истощение, ухудшить качество жизни. Расчетным показателем является 1-1,2 г белка на кг массы тела в сутки, а иногда и больше. Очень важно, чтобы в пищу употреблялись полноценные белки, содержащие незаменимые аминокислоты. Из животных белков следует предпочитать белки куриных яиц и мяса птицы.
Напомним: все рекомендации по режиму питания, изложенные выше, носят ориентировочный характер!
Определить его окончательно, обосновать необходимость введения пищевых добавок и их тип может только врач!
Необходимо научиться рассчитывать собственную энергетическую потребность!
Несмотря на то, что пациенты с ХПН на программном гемодиализе обычно получают много белка, значительная часть их энергетической потребности покрывается за счет жиров и углеводов.
Как и в додиализном периоде, предпочтение следует отдавать растительным жирам. Целесообразно употребление рыбьего жира, однако необходимость его применения и дозу следует согласовать с врачом!
Потребление углеводов у больных с ХПН на диализе подчиняется, в общем, тем же правилам, что и у пациентов в додиализном периоде. Следует вновь предупредить, что высокоуглеводные продукты с большим содержанием калия противопоказаны.
Потребность в витаминах у больных при лечении ГД возрастает. Обычно таким пациентам приходится принимать дополнительное количество витаминов в виде таблеток, порошков и т.д. Однако бесконтрольный прием современных витаминных препаратов опасен и может вызвать тяжелые осложнения. Все витаминные добавки больной с ХПН в диализном периоде должен применять только по назначению врача!
Принципы питания при гемодиализе (диета № 7Г):
1) с учетом потерь белка и аминокислот при диализе, его частоты и продолжительности содержание белка в рационе составляет от 0,8 до 1,2 г на 1 кг нормальной массы тела больного, в среднем 60—70 г (70— 75% животные);
2) физиологически нормальная энергоценность рациона из расчета 35 ккал на 1 кг массы тела (в среднем 2100— 2400 ккал) при нормальном содержании углеводов (300—350 г) и ограничении сахара, умеренном ограничении жиров за счет животных жиров (70—80 г, из них 30% растительных масел). Особенности состава углеводов и жиров важны для предупреждения нарушений жирового обмена, но имеют меньшую значимость, чем энергоценность рациона. Поэтому при плохом аппетите допустимо увеличение легкоусвояемых углеводов (мед, варенье и др.) в диете;
3) количество поваренной соли и жидкости в рационе зависит от уровня артериального давления и степени задержки воды в организме. При артериальной гипертензии и задержке воды потребление соли и жидкости резко ограничивают. При сохранении мочевыделения (диуреза) количество жидкости составляет 0,4—0,5 л плюс величины суточного диуреза. Пищу готовят без соли, хлеб бессолевой. При отсутствии артериальной гипертензии и отеков выдают на руки больному 3—4 г поваренной соли;
4) в рационе увеличивают содержание кальция (не менее 1 г), железа, витаминов С и группы В за счет их пищевых источников и препаратов; количество фосфора ограничивают до 1 г в день; потребление калия — не более 2—3 г в день, а при уменьшении диуреза (олигурия) исключают богатые калием продукты;
5) для улучшения вкусовых качеств пищи необходима разнообразная кулинарная обработка, включая тушение и легкое обжаривание, добавление пряных овощей и пряностей, лимонной кислоты, уксуса и т. д.;
6) рацион планируется индивидуально с учетом частоты и продолжительности гемодиализа и состояния больного.
Диета может отличаться в дни диализа и дни без него. При потере аппетита в дни диализа надо обеспечить увеличение потребления пищи между днями процедур. Целесообразен частый прием пищи малыми порциями.
В диете № 7Г рекомендуются следующие продукты и блюда с ориентировочным указанием их количества:
1) хлеб бессолевой из муки высшего сорта — 150 г или меньше при увеличении в рационе круп;
2) супы (до 250 г) овощные (борщ, щи и др.), с саго, молочные;
3) мясо и рыба нежирных сортов — до 100 г, различные блюда после отваривания с последующим запеканием или обжариванием;
4) молоко и кисломолочные напитки — 150—200 г, сметана — 50 г, творог — 30—40 г; яйца — 1 —1,5 штуки всмятку, в блюда, белковые омлеты;
крупы ограниченно, предпочтительны саго, рис; в среднем 200 г картофеля и 300 г овощей, различные блюда;
5) закуски в виде овощных и фруктовых салатов, винегретов;
6) фрукты и ягоды — 250—300 г, в сыром и вареном виде, муссы, желе; мед, варенье, до 20 г сахара; соусы томатный, сметанный, кисло-сладкие и кислые овощные и фруктовые подливки, лимонная кислота, уксус, пряные овощи и пряности, ограниченно — хрен, перец, горчица;
7) некрепкий чай, кофейные напитки, овощные и фруктовые соки; 20 г сливочного и 25 г растительного масла.
Какие витамины принимать при гемодиализе
ПРАВИЛА ПИТАНИЯ ПРИ ЛЕЧЕНИИ ГЕМОДИАЛИЗОМ
В. М. Кузнецова ООО «Ярославский диализный центр»
Гемодиализ – метод лечения больных хронической почечной недостаточностью (ХПН), основанный на диффузии из крови через полупроницаемую мембрану азотистых шлаков и других веществ, задерживающихся в крови при уремии. Гемодиализ проводят аппаратом «искусственная почка» с помощью диализирующих растворов.
Регулярный гемодиализ не заменяет в полной мере утраченные функции почек, и у больных сохраняется ряд нарушений обмена веществ, свойственных ХПН. Кроме того, диализная терапия имеет побочные эффекты, ведущие, в частности, к потерям ряда питательных веществ. Поэтому состояние больных, находящихся на хроническом гемодиализе, во многом определяется правильной диетотерапией. Напомним, что здоровые почки работают 24 часа в сутки, а искусственная – только 3 раза в неделю по 4 часа. Поэтому необходимо строго следить за тем, чтобы в период между сеансами диализа организм не получал избытка токсических веществ и жидкости. Несоблюдение предписанного режима питания может привести к тяжелым осложнениям: отеку легких, отеку мозга или даже летальному исходу.
Принципы питания при регулярном гемодиализе
1. Потребление белка и энергии.
Ведущим вопросом диетотерапии является количество и качество белка в рационе больных, получающих диализную терапию. Этот вопрос тесно связан с энергоценностью рациона, так как улучшение азотистого баланса может быть достигнуто только при одновременном увеличении потребления белка и энергии.
Достаточно высокое количество полноценного белка в диете определяется потерями белка и аминокислот, обусловленными диализом, остаточной протеинурией, гиперкатаболизмо м белка и угнетением его синтеза в организме, ухудшением пищеварения. Так, при гемодиализе потери белка могут достигать 5 – 8 г за одну процедуру гемодиализа. Недостаточное потребление больными белка и источников энергии в связи с анорексией также обусловливает необходимость его дополнительного включения при диализе.
Максимальный уровень потребления белка рекомендуется при осложнениях – инфекции, кровотечения и др. Однако, избыточное содержание белка в рационе ведет к увеличению азотистых шлаков, гиперфосфатемии, метаболическому ацидозу и нарастанию клинических симптомов уремии. Альтернативой является использование препаратов незаменимых аминокислот и (или) кетокислот, например, «Кетостерила».
Источником полноценного белка в диетах при гемодиализе должны быть нежирное мясо и умеренно жирная рыба (120 – 150 г брутто) в виде различных блюд после отваривания. Яйца (2 – 3 шт. в день), в умеренном количестве молоко, сливки. Кисломолочные напитки (100 – 200 г), сметана (100 – 200 г), творог 20 – 40 г. Указанные величины имеют сугубо ориентировочный характер.
2. Потребление жиров и углеводов.
Вопрос о составе жиров и углеводов в диете при гемодиализе имеет важное, хотя и не первостепенное значение. При диализной терапии наблюдаются нарушения липидного и углеводного обмена, связанные с изменением эндокринной функции почек, гормональным дисбалансом, изменением чувствительности тканей – мишеней к гормонам при ХПН. Нарушение липидного обмена способствует развитию атерогенной сердечно-сосудис той патологии. Гемодиализ незначительно нормализует липидный спектр крови при ХПН, и только диета с ограничением легкоусвояемых углеводов приводит к уменьшению гипертриглицерид емии.
Таким образом, питание при диализной терапии не следует перегружать жирами и углеводами. Необходимо включать в рацион источники полиненасыщенных жирных кислот семейства омега – 6 (растительные масла) и омега – 3 – жиры морской рыбы.
Указанные особенности состава жиров и углеводов важны для нормализации липидного обмена. При плохом аппетите и самочувствии больных допускается увеличение потребления легкоусвояемых углеводов (мед, варенье, некоторые кондитерские изделия и др.), если это приятно больному и обеспечивает нужное потребление энергии.
Суточная потребность жиров составляет, в среднем, 110 г. Разрешается масло сливочное и растительное. Тугоплавкие жиры исключаются. Суточная потребность углеводов 450 г.
3. Потребление натрия и свободной жидкости.
Употребление 9 г соли в сутки приводит к задержке в организме воды около 1 л воды!
Содержание натрия в 100 г съедобной части продуктов
Опыт лечения тяжелых нарушений фосфорно-кальциевого обмена при терминальной почечной недостаточности с использованием цинакалцета
Хронические заболевания почек представляют собой серьезную проблему здравоохранения. Это определяется как неуклонным ростом числа больных с хронической почечной недостаточностью, так и высокой стоимостью и относительно неудовлетворительными исходами их ле
Хронические заболевания почек представляют собой серьезную проблему здравоохранения. Это определяется как неуклонным ростом числа больных с хронической почечной недостаточностью, так и высокой стоимостью и относительно неудовлетворительными исходами их лечения [1]. Анализ Базы данных пациентов с заболеваниями почек (USRDS) и результатов исследования NHANES III в США показал, что около 26 млн взрослых, то есть примерно 14,6% от числа населения старше 20 лет, страдают хроническими заболеваниями почек [4]. За последние пять лет число больных, находящихся на заместительной почечной терапии, увеличилось более чем на 25% и на данный момент составляет более 2 млн человек. При этом наибольшее количество больных, получающих заместительную почечную терапию, зарегистрировано в Японии (2230 пациентов на 1 млн жителей) и в США (1650 больных на 1 млн жителей). Наибольший рост числа таких пациентов зафиксирован в развивающихся странах (в том числе в России) — свыше 50% за 5 лет [6].
Исходя из данных о весьма значительной распространенности хронических заболеваний почек и динамике прироста терминальной стадии хронической почечной недостаточности в течение последних 20 лет эксперты прогнозируют и в будущем дальнейший рост численности этой категории больных, тем более что, благодаря значительному техническому прогрессу, заместительная почечная терапия в настоящее время может применяться практически без ограничений [4].
Проблема лечения терминальной стадии хронической почечной недостаточности усугубляется тем, что, несмотря на значительный прогресс в заместительной почечной терапии, ее прогноз все еще остается весьма неблагоприятным. В США сохраняется высокая годичная летальность пациентов, находящихся на заместительной почечной терапии, — более 20%. Ожидаемая продолжительность их жизни значительно короче, чем в сходной возрастной группе. Так, для пациентов в возрасте от 40 до 44 лет она составляет 7,1–11,5 года, а для пациентов от 60 до 64 лет — 2,7–3,9 года. Частота сопутствующих заболеваний у больных с хроническими заболеваниями почек также высока. Их среднее количество у больного, находящегося на заместительной почечной терапии, равно четырем, и основную роль при этом играют заболевания сердечно-сосудистой системы [22].
Пациенты с хроническими заболеваниями почек имеют большую вероятность умереть от осложнений своего заболевания, чем дожить до потребности в диализе. Летальность вследствие заболеваний сердца среди пациентов с терминальной стадией хронической почечной недостаточности в 10 раз выше, чем в общей популяции. Например, по данным американского регистра 2002 года у больных с почечной недостаточностью в 24,8% случаев выявлена ишемическая болезнь сердца, а в 8,7% — инфаркт миокарда [29]. У пожилых пациентов с хронической почечной недостаточностью частота ишемической болезни сердца выше на 22%, латентной ишемии — на 16%, а новых коронарных событий — в 3,4 раза по сравнению с пациентами без нарушения функции почек [6]. По данным исследования HOPE легкая почечная недостаточность (креатинин плазмы 124–200 мкмоль/л), независимо от других факторов риска и лечения, ассоциировалась с увеличением сердечно-сосудистой смертности от инфаркта миокарда и инсульта на 40% [25].
Предметом интереса недавних исследований стал вопрос, в какой мере сопутствующие сердечно-сосудистые заболевания могут быть связаны с нарушениями функции паращитовидных желез, развивающимися параллельно со снижением функции почек. Концепция, в соответствии с которой воздействие на рецепторы, подобные рецепторам паращитовидных желез, обнаруженные во многих органах и тканях, могут играть определенную роль в развитии и прогрессировании сердечно-сосудистых заболеваний у пациентов с хроническими заболеваниями почек, является относительно новой [2].
Вторичный гиперпаратиреоз при хронических заболеваниях почек
У пациентов с хроническими заболеваниями почек нарушенный синтез гормонально-активного витамина D в сочетании с длительной гиперкальциемией и повышенным уровнем фосфатов приводит к вторичному гиперпаратиреозу, одному из наиболее частых и тяжелых осложнений (около 30% пациентов, находящихся на программном гемодиализе) [12]. Это состояние, характеризующееся компенсаторной гиперсекрецией паратиреоидного гормона, приводит как к морфологическим изменениям паращитовидных желез, так и к развитию фиброзного остеита, потере костной массы и к сопутствующим сердечно-сосудистым заболеваниям [20]. Как правило, уровни паратиреоидного гормона в крови начинают повышаться при уменьшении скорости клубочковой фильтрации ниже 60 мл/мин/1,73 м2 [22]. К настоящему времени вопрос о времени появления у пациентов с хроническими заболеваниями почек сопутствующих сердечно-сосудистых заболеваний, их каузальной связи с дисфункцией паращитовидных желез и возможности обратного развития на фоне патогенетического лечения вторичного гиперпаратиреоза до конца не ясен [2, 3].
Давно известно, что паратиреоидный гормон оказывает воздействие на функционирование многих органов и систем [3]. При уремии, выделяясь в супрафизиологических концентрациях, он приобретает черты «универсального уремического токсина», вызывая плейотропную органную дисфункцию. Гиперсекреция паратиреоидного гормона способствует развитию ренальной остеодистрофии, уремической кардиомиопатии, «кальцификации миокарда», клапанов сердца и его проводящей системы, диффузному фиброзу миокарда, внескелетной кальцификации, артериальной гипертензии, ускорению развития атеросклероза, генерализованной васкулопатии, энцефалопатии; влияет практически на все стадии гемопоэза; нарушает секрецию инсулина [3, 15, 17, 20, 25, 31]. Эти события неразрывно связаны (по крайней мере, частично) с избыточной концентрацией паратиреоидного гормона и плохо корригируются заместительной почечной терапией.
Вторичная гиперплазия паращитовидных желез с повышением уровня паратиреоидного гормона в крови развивается практически у всех больных с хроническими заболеваниями почек. Вторичный гиперпаратиреоз у больных с хроническими заболеваниями почек — это компенсаторная гиперфункция паращитовидных желез, исходно направленная на поддержание физиологических параметров минерального и костного обмена, приводящая при прогрессировании почечной недостаточности к необратимым морфологическим изменениям (гипертрофии и гиперплазии главных клеток) паращитовидных желез [3].
Таким образом, своевременная диагностика, профилактика и адекватное лечение вторичного гиперпаратиреоза чрезвычайно важны для повышения качества и продолжительности жизни пациентов с хроническими заболеваниями почек.
Патогенез вторичного гиперпаратиреоза при хронических заболеваниях почек
Патогенез вторичного гиперпаратиреоза при хронических заболеваниях почек до конца не ясен и продолжает уточняться. В развитии вторичного гиперпаратиреоза играют роль разнообразные факторы, что приводит к запуску целого каскада биохимических и патофизиологических изменений, приводящих к необратимым морфологическим изменениям паращитовидных желез [2, 3, 22, 23]: транзиторная и/или персистирующая гиперфосфатемия (ретенция фосфатов); резистентность рецепторов органов-мишеней к паратиреоидному гормону; изменение метаболизма витамина D.
На сегодняшний день в целом остается верной гипотеза Bricker N.?S. (1972), в основу которой были положены представления о том, что при хронической почечной недостаточности главным стимулом к развитию вторичного гиперпаратиреоза является гипокальциемия, которая возникает в ответ на гиперфосфатемию, связанную с ретенцией фосфатов [7, 8]. При хронической почечной недостаточности, особенно в терминальной ее стадии, происходит патологическая фенотипическая модуляция рецепторов (в т. ч. из-за изменения молекулярной структуры и их количества) к ионизированному кальцию на поверхности клеток паращитовидной железы и других органов-мишеней (кость, кишечник, сосуды и прочее), что кардинально изменяет гомеостаз кальция. В результате происходит сдвиг секреторной set-point и клетки паращитовидных желез начинают высвобождать паратиреоидный гормон в ответ не только на низкую, но и на нормальную концентрацию ионизированного кальция в крови больного [5, 9]. Снижение концентрации в крови 1,25-дигидроксихолекальциферола и увеличение концентрации фосфатов также являются прямыми стимуляторами синтеза паратиреоидного гормона [7, 8].
Эти представления легли в основу широкого клинического применения у пациентов, находящихся на заместительной почечной терапии, гипофосфатной диеты, фосфат-связывающих препаратов и кальцитриола. В результате удалось добиться более благоприятного течения ренальных остеодистрофий. Однако это не уменьшило остроту проблемы вторичного гиперпаратиреоза и связанных с ним осложнений со стороны сердечно-сосудистой системы.
Современные стандартные подходы к лечению вторичного гиперпаратиреоза при хронических заболеваниях почек
Современная (стандартная) терапия нарушений минерального обмена и связанных с ним осложнений включает диетические рекомендации по ограничению приема фосфатов, прием аналогов витамина D и фосфат-связывающих препаратов. Это в ряде случаев позволяет контролировать показатели фосфорно-кальциевого обмена и уровень паратиреоидного гормона в пределах целевых значений, установленных K/DOQI [22]. Целью терапии вторичного гиперпаратиреоза является снижение четырех лабораторных показателей: уровня паратиреоидного гормона, кальция и фосфора в сыворотке крови, а также фосфорно-кальциевого произведения (табл. 1).
Cтандартная терапия нарушений минерального и костного обмена по данным литературы более чем в половине случаев не позволяет достичь необходимого клинического эффекта, а в некоторых ситуациях даже противопоказана [20].
Так, лишь 47,5% пациентов, находящихся на программном гемодиализе, соблюдают диету, направленную на ограничение фосфатов, при этом уровень фосфора и кальция сыворотки у этой группы больных не имеет достоверных различий по сравнению с пациентами, не соблюдающими диету. Кроме того, содержание фосфора в различных диетах, назначаемых пациентам, варьирует от 550 до 1000 мг/сутки (18–36 ммоль/сутки), что затрудняет контроль количества поступающих с пищей фосфатов [2].
Адекватный гемодиализ также не всегда позволяет справиться с нарушениями минерального обмена. Известно, что современная гемодиализная терапия позволяет удалять лишь лимитированное количество фосфатов: от 20 до 40 ммоль за сеанс, что за неделю составляет 60–120 ммоль [24]. Более того, риск развития тяжелых форм гиперпаратиреоза (и, как следствие,?— относительный риск смерти) у таких больных прямо пропорционален продолжительности нахождения на гемодиализе (смертность в этой группе больных составляет 44% за 4 года) [1]. Эффективным является увеличение диализного клиренса фосфатов с использованием ежедневного дневного или ночного гемодиализа, гемодиафильтрации [11]. Однако такой подход неприменим в широкой клинической практике.
Эффективность терапии активными формами витамина D, например кальцитриолом, также зачастую не оправдывает ожиданий. Применение этой группы препаратов ограничено, во-первых, из-за исходной или развивающейся на фоне лечения резистентности, что требует назначения их в дозах, превышающих физиологические. Во-вторых, имея относительно узкое «терапевтическое окно» и усиливая всасывание кальция и фосфора в желудочно-кишечном тракте, они приводят к гиперкальциемии, усугубляют гиперфосфатемию и увеличивают фосфорно-кальциевое произведение [28]. Предполагаемые механизмы резистентности к лечению активированными аналогами витамина D при хронической почечной недостаточности включают в себя: опосредованные уремией снижение транспорта кальцитриола в паращитовидные железы; снижение образования комплекса кальцитриол–рецепторы к витамину D; снижение содержания функциональных рецепторов к витамину D в ткани паращитовидных желез [12]. Парикальцитол (Земплар) — синтетический селективный активатор рецепторов витамина D.
Подобные парикальцитолу модифицированные аналоги витамина D имеют меньший кальциемический эффект и, соответственно, более широкое терапевтическое окно [12, 19]. Кроме того, они быстрее, чем кальцитриол, подавляют секрецию паратиреоидного гормона и приводят к менее выраженному увеличению концентрации кальция и фосфора в сыворотке [27]. Парикальцитол сохраняет свою способность снижать паратиреоидный гормон у пациентов с гиперфосфатемией или с устойчивостью к терапии кальцитриолом [18].
Традиционное применение кальциевых фосфат-биндеров позволяет в ряде случаев корригировать гиперфосфатемию и гипокальциемию. Однако эта группа препаратов позволяет абсорбировать не более 50% потребляемого фосфора [16]. Кроме того, как любой другой препарат, фосфат-биндеры не лишены побочных эффектов: гиперкальциемия за счет всасывания кальция; связывание в кишечнике железа наряду с фосфатом; желудочно-кишечные расстройства. Необходимо считаться с тем, что на стандартной диете (1–1,2 г/кг/сутки белка) эффективны только высокие дозы карбоната кальция (9–10 г/сутки). Длительное применение таких доз карбоната кальция в 60% случаев осложняется гиперкальциемией. В настоящее время созданы фосфат-биндеры на полимерной основе, не содержащие ни алюминия, ни кальция и не всасывающиеся в кишечнике: севеламера гидрохлорид (RenaGel), севеламера карбонат (Renvela), Genzyme, Ирландия. Основное различие между ними состоит в том, что последний не вызывает метаболического ацидоза и таким образом не способствует прогрессированию костной болезни. Однако опыта применения этой группы препаратов в России пока нет [2].
В качестве крайней меры пациентам с осложненными формами вторичного гиперпаратиреоза применяется оперативное лечение, которое, к сожалению, подчас также оказывается неэффективным [2].
Указанные трудности в лечении нарушений минерального и костного обмена у больных с хроническими болезнями почек способствовали разработке и внедрению в клиническую практику принципиально новой группы препаратов — кальцимиметиков, изменяющих чувствительность рецепторов паращитовидных желез. Цинакалцет (Код АТХ: Н05ВХ01) производится международной биотехнологической компанией AMGEN (США) и зарегистрирован в Северной Америке под торговым названием Сенсипар, а в Европе — Мимпара.
В России препарат появился относительно недавно, поэтому достаточный опыт его практического применения еще не накоплен. За рубежом цинакалцет активно применяется с 2004 года более чем в 34 странах и хорошо зарекомендовал себя не только с клинической, но и с экономической точки зрения, позволяя заметно снизить затраты на лечение тяжелых осложнений хронических заболеваний почек.
Цинакалцет обладает прямым кальцимиметическим действием, непосредственно снижающим уровень паратиреоидного гормона, повышая чувствительность рецептора к внеклеточному кальцию. Снижение уровня паратиреоидного гормона коррелирует с концентрацией цинакалцета в крови. После перорального приема цинакалцета его максимальная концентрация в плазме крови достигается примерно через 2–6 часов, что сопровождается максимальным снижением уровня паратиреоидного гормона в крови. После этого концентрация цинакалцета начинает снижаться, а уровень паратиреоидного гормона повышается в течение 12 часов после введения дозы, в последующем супрессия паратиреоидного гормона остается примерно на одном и том же уровне до конца суточного интервала при режиме дозирования один раз в день. Примерно 80% вводимой дозы цинакалцета выводится почками, 15% — через желудочно-кишечный тракт. Снижение концентрации цинакалцета происходит в два этапа: первоначальный период полувыведения составляет примерно 6 часов, окончательный — от 30 до 40 часов. Стабильное содержание препарата достигается в течение 7 дней с минимальной кумуляцией. После достижения стабильной фазы концентрация кальция в сыворотке крови остается на постоянном уровне в течение всего интервала между приемами препарата. По данным литературы цинакалцет позволяет существенно снизить уровень паратиреоидного гормона уже к концу второй недели лечения.
В качестве иллюстрации вышесказанному приводится следующий клинический пример:
Больная Х., 64 года, с декабря 2005 года находится на лечении программным гемодиализом (в ГВКГ им. Н.?Н.?Бурденко с апреля 2007 года) по поводу терминальной почечной недостаточности в исходе диабетической нефропатии в сочетании с хроническим пиелонефритом. С 1965 года диагностируется алиментарно-конституциональное ожирение 2–3 степени, с 1996 года — сахарный диабет 2-го типа средней тяжести, а затем — тяжелого течения. С 1998 года — ишемическая болезнь сердца: клиника нагрузочной стенокардии отсутствовала, диагноз верифицирован на основании признаков «безболевой ишемии» миокарда и AV-блокады I степени по данным суточного мониторирования электрокардиограммы. Примерно с того же времени повышение уровня артериального давления (АД) до 220 и 140 мм рт. ст., адаптирована к АД 160/100 мм рт. ст. Постоянная четырехкомпонентная гипотензивная терапия в составе: Альбарел 2 мг/сутки, Амловас 20 мг/сутки, Аккупро 20 мг/сутки, Эгилок 100 мг/сутки — позволяла поддерживать целевой уровень АД (не свыше 140/90 мм рт. ст.) до 2005 года. С целью профилактики атеросклеротических осложнений постоянно принимала статины в суточной дозе 10 мг.
С начала 2005 года присоединяются клинико-лабораторные и инструментальные признаки прогрессирования атеросклероза, «озлокачествления» гипертензивного синдрома: в январе 2005 года появляется микроальбуминурия, которая уже в марте сменяется протеинурией до 1,5 г/сутки; несмотря на регулярный прием рекомендованных гипотензивных препаратов развивается лабильность АД. В связи с этим по рекомендации врачей поликлиники при ситуационном повышении АД свыше 160/100 мм рт. ст. (до двух-трех раз в неделю) принимала дополнительно Кордафлекс 40 мг/сутки. По данным визуализирующих методов исследования (эхокардиографии, рентгенографии органов грудной клетки) определяется достаточно быстрое увеличение массы миокарда (исходно 345 г, в последующем 436 г) с появлением признаков диастолической дисфункции первого типа и клинических симптомов хронической сердечной недостаточности на уровне функциональной классификации (ФК) II, метастатической кальцификации мягких тканей, крупных сосудов и створок аортального клапана (атеросклеротический стеноз устья аорты), что в тот период времени трактовалось как следствие особенно тяжелого течения атеросклероза, и в связи с этим увеличивается суточная доза статинов до 20 мг.
В декабре 2005 года на фоне роста азотемии (креатинин сыворотки крови 780 мкмоль/л) в результате обострения пиелонефрита, присоединения пневмонии у больной диагностируется терминальная стадия хронической почечной недостаточности и начинается лечение программным гемодиализом (3 раза в неделю по 4 часа), проведение которого вначале сопровождалось усугублением тяжести гипертензивного синдрома (АД до 240/140 мм рт. ст.). В марте 2006 и феврале 2007 года на фоне плохо поддающейся коррекции артериальной гипертензии переносит повторные острые нарушения мозгового кровообращения в бассейне левой среднемозговой артерии с исходом в правосторонний гемипарез и сенсорно-моторную афазию. В апреле 2007 года для продолжения лечения переводится в ГВКГ им. Н.?Н.?Бурденко.
В этот период у больной сохраняется выраженная артериальная гипертензия (180–200/80–90 мм рт. ст.), резистентная к стандартной ультрафильтрации и вышеуказанной медикаментозной терапии. Проведение гемодиализа с ультрафильтрацией в ежедневном режиме в течение 6 дней в неделю позволило снизить «сухой вес» на 6 кг, что сопровождалось стабилизацией АД на уровне 160/90 мм рт. ст. Концентрация фосфора в сыворотке крови составляла 2,51 ммоль/л, кальция — 2,62 ммоль/л (фосфорно-кальциевое произведение = 6,58 ммоль2/л2), уровень паратиреоидного гормона — 24,8 пг/мл. Учитывая «высокое» фосфорно-кальциевое произведение и нормальное содержание паратиреоидного гормона, медикаментозная терапия не назначалась, больной рекомендовалась гипофосфатная диета и прием карбоната кальция (до 3 г в сутки), однако соблюдение диетических правил оказалось невозможным из-за двигательных расстройств (правосторонняя гемиплегия) и низкого комплаенса (дисциркуляторная энцефалопатия с выраженными когнитивными расстройствами). Это в течение трех месяцев привело к усугублению гиперфосфатемии и гиперкальциемии (3,0 ммоль/л и 2,7 ммоль/л соответственно).
Несмотря на почти полное обездвиживание больной, предрасполагающее к развитию адинамической болезни кости, появляются лабораторные и клинические признаки гиперпаратиреоза: увеличение уровня паратиреоидного гормона до 488 пг/мл, присоединение нестерпимого кожного зуда. Ультразвуковое исследование паращитовидных желез не выявило аденоматозных изменений. Высокий уровень фосфора сделал невозможным назначение активированных аналогов витамина D. Было принято решение об изменении диализной программы с увеличением времени диализа до 15 часов в неделю и добавлением к стандартному гемодиализу еженедельно проводимой гемодиафильтрации (конвекционный клиренс — 21 литр в неделю), использовались также индивидуальные диализаторы с мембраной повышенной сорбционной активности (полиметилметакрилат) с достижением недельного Kt/V до 3,75. Это позволило приостановить прогрессирование клинических и лабораторных признаков гиперпаратиреоза (уровень паратиреоидного гормона к декабрю 2008 года составлял 504 пг/мл), выраженность кожного зуда уменьшилась, однако уровень фосфора и кальция по-прежнему оставался высоким (фосфорно-кальциевое произведение > 8,2 ммоль2/л2). Когда все методы современной терапии нарушений фосфорно-кальциевого и костного обмена были исчерпаны, нами был назначен цинакалцет (декабрь 2008 года) в стартовой дозе 30 мг/сутки.
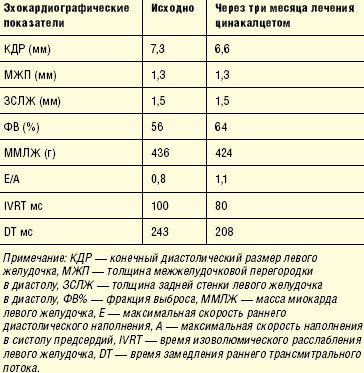
В дальнейшем контроль показателей фосфорно-кальциевого обмена и уровня паратиреоидного гормона осуществлялся один раз в месяц. С целью оценки возможного влияния цинакалцета на уровень АД, функцию сердечной мышцы ежемесячно выполнялись трансторакальная эхокардиография, суточное мониторирование АД и ЭКГ. Оценка нарушений диастолической функции левого желудочка сердца выполнялась по общепринятым критериям [10, 13, 14]. Ежедневно контролировались масса тела, уровень АД и частота сердечных сокращений (ЧСС) (утром и вечером).
Динамический контроль за указанными параметрами показал, что через 2 недели лечения у больной Х. стойко снизился уровень как систолического, так и диастолического АД (со 160/90 мм рт. ст. до 140/80 мм рт. ст.), уменьшилась ЧСС (с 90 до 78 ударов в минуту), что подтверждалось данными СМАД и ХМЭКГ в январе 2009 года. Снижение АД и урежение ЧСС позволило откорректировать в сторону уменьшения состав гипотензивной терапии: постепенно были полностью отменены Эгилок и Кордафлекс. Уровни паратиреоидного гормона, кальция и фосфора крови оставались прежними. Поскольку в «Инструкции по применению цинакалцета» заявлено, что транзиторное снижение паратиреоидного гормона начинается через 6 часов после приема первой дозы, а стойкое — через 7 дней лечения, отсутствие эффекта через месяц приема препарата у нашей больной было расценено как следствие недостаточной начальной дозы, в связи с чем она была увеличена до 60 мг/сутки (2 таблетки). Однако появление через два дня стойкой тошноты заставило нас вернуться к исходной дозе цинакалцета 30 мг в сутки. Начальное снижение уровня паратиреоидного гормона до 345 пг/мл отмечено лишь в феврале 2009 года — на третьем месяце лечения цинакалцетом в дозе 30 мг/сутки. Еще через месяц начали снижаться уровни кальция, фосфора в крови и фосфорно-кальциевое произведение. Прием цинакалцета в той же дозе в монотонном режиме в течение четырех месяцев позволил практически нормализовать концентрацию кальция и фосфора сыворотки крови (соответственно 2,06 и 2,24 ммоль/л) к июлю 2009 года, а также снизить активность паратиреоидного гормона до 155 пг/мл.
Исходно масса миокарда была повышена до 436 г за счет концентрической гипертрофии и в последующем не изменилась, однако через три месяца лечения цинакалцетом улучшились эхокардиографические показатели функционального состояния сердечной мышцы. Если в начале периода наблюдения имелись все признаки диастолической дисфункции первого типа, характеризующейся нарушением релаксации левого желудочка (аномальная релаксация) и патогенетически связанной с гипертрофией левого желудочка, повышенным уровнем артериального давления и паратиреоидного гормона, то через три месяца лечения цинакалцетом они регрессировали (табл. 2). Незначительно увеличилась фракция изгнания левого желудочка.
Обсуждение
Таким образом, только комплексный подход к лечению нарушений фосфорно-кальциевого обмена и вторичного гиперпаратиреоза с включением в фармакологическую комбинацию кальцимиметиков (цинакалцет) у больной, находящейся на заместительной почечной терапии, позволил поддерживать целевые уровни фосфорно-кальциевого обмена и паратиреоидного гормона, рекомендованные K/DOQI.
В приведенном клиническом случае традиционные подходы к коррекции минерального и костного обмена и связанного с ними вторичного гиперпаратиреоза у больной с терминальной стадией хронической почечной недостаточности, находящейся на гемодиализе, оказались неэффективными, как нам видится, по следующим причинам: невозможность соблюдения гипофосфатемической диеты и приема фосфат-биндеров (карбоната кальция) пациенткой с интеллектуально-мнестическими и двигательными расстройствами; назначение аналогов активированного витамина D (кальцитриол) было ограничено гиперкальциемией.
Дополнение комплексного лечения нарушений минерального обмена цинакалцетом позволило в течение трех месяцев достичь целевых значений минерального обмена и уровня паратиреоидного гормона. Преимуществом цинакалцета в данном случае мы считаем, помимо его очевидной эффективности в отношении гиперфункции паращитовидных желез и минерального обмена, возможность точного дозирования и однократного приема в течение суток.
Более спокойное течение артериальной гипертензии на наш взгляд явилось следствием комплекса причин: сыграли свою роль устранение гипергидратации (исходная масса тела составляла 90 кг, в последующем — 84 кг), успешная коррекции фосфорно-кальциевого обмена и снижение уровня паратиреоидного гормона. Учитывая относительно быстрое достижение нормотензии без увеличения количества и суточной дозировки антигипертензивных препаратов, нельзя исключать непосредственный гипотензивный эффект цинакалцета. Экспериментально были установлены как прямой, так и опосредованный повышенной продукцией NO вазодилятирующий эффект цинакалцета [26], а также его ингибирующее влияние на выработку ренина юкстагломерулярным аппаратом почек [23].
Диспептический синдром в виде тошноты и тяжести в эпигастрии, развившийся на следующий день после увеличения вдвое (до 60 мг) суточной дозы цинакалцета, регрессировал после возвращения к исходной дозе 30 мг так же быстро, как и развился, что не потребовало отмены препарата. Лабораторно-инструментальное обследование (фиброгастродуоденоскопия, ультразвуковое исследование органов брюшной полости, биохимическое тестирование общей и панкератической амилазы в крови и диастазы в моче) не выявило какой-либо патологии со стороны дуоденохоледохопанкреатической зоны, что позволило нам рассматривать развитие данного симптомокомплекса в рамках побочного действия цинакалцета и сделать предварительный вывод о хорошей переносимости препарата. По результатам контролируемых клинических исследований (данные о 656 больных, принимавших цинакалцет, и о 470 больных, принимавших плацебо) наиболее часто встречающимися побочными эффектами были тошнота и рвота, которые отмечались у 31% больных в группе терапии цинакалцетом и у 19% больных в группе плацебо, а также у 27% больных в группе терапии цинакалцетом и у 15% в группе плацебо. Тошнота и рвота были легкой и умеренной степени выраженности и в большинстве случаев носили кратковременный характер. Прекращение терапии в результате развития нежелательных эффектов было вызвано главным образом тошнотой (5%) и рвотой (4%).
Причиной нарушения диастолической функции левого желудочка у больной Х. на наш взгляд являлась концентрическая гипертрофия миокарда, как один из наиболее часто встречающихся вариантов ремоделирования левого желудочка у больных, длительно страдающих артериальной гипертензией и сахарным диабетом. Через три месяца приема цинакалцета стали регрессировать клинические симптомы хронической сердечной недостаточности и эхокардиографические признаки диастолической дисфункции, что более вероятно обусловлено как снижением АД до целевого уровня, так и устранением кардиотоксического действия супрафизиологических коцентраций паратиреоидного гормона. Сыграла свою роль и отмена бета-блокаторов, что стало возможным после назначения цинакалцета, поскольку эта группа препаратов негативно влияет на податливость миокарда. К сожалению, четких рекомендаций и схем терапии больных с диастолической хронической сердечной недостаточностью в настоящее время не существует. Европейское общество кардиологов (ESC) в 1997 г. опубликовало лишь общие направления терапии хронической сердечной недостаточности у больных с диастолической дисфункцией [29]. Поэтому любой положительный опыт лечения нарушений диастолической функции левого желудочка должен тщательно анализироваться.
Кроме того, минимальная эффективная поддерживающая доза цинакалцета 30 мг/сутки, что соответствует 1 упаковке (28 таблеток) на месяц, позволяет говорить о приемлемом фармакоэкономическом профиле препарата.
Таким образом, первый опыт применения цинакалцета при вторичном гиперпаратиреозе у пациентки с терминальной стадией хронической почечной недостаточности, находящейся на программном гемодиализе, оказался более чем положительным. Конечно, для выявления корреляции между снижением уровня паратиреоидного гормона и улучшением течения сердечно-сосудистой патологии необходимо накопить достаточный клинический опыт. Последующие исследования могут подтвердить или опровергнуть данное утверждение.