цистин это какой витамин
L-цистин
Цистин (3,3′-дитио-бис-2-аминопропионовая кислота, дицистеин). Каждая молекула цистина состоит из двух молекул цистеина.
Цистин – представляет собой бесцветные кристаллы, растворимые в воде. Образуется при окислении цистеина кислородом воздуха в щелочных растворах.
Аминокислоты метионин, цистеин и цистин метаболически тесно связаны друг с другом. Благодаря наличию в составе цистеина высокореактивной SH-группы в тканях легко осуществляется ферментативная окислительно-восстановительная реакция между цистеином и цистином. Цистеин образует с цистином окислительно-восстановительную пару, причем цистин играет роль восстановителя.
В форме кислоты входят в состав многих белков и природных пептидов. Особенно высоко содержание цистина в кератинах, которые в свою очередь явaляются производным белка ногтей, кожи и волос.
Пищевые источники цистина: рыба, овес, соя, рис, пшеница, яичный желток, лук и чеснок.
Функции в организме
Участвует в формировании пространственных структур ряда белков и пептидов, например инсулина, соматостатина и иммуноглобулинов.
Участвует в процессах формирования тканей кожи, способствует формированию коллагена и улучшает эластичность и текстуру кожи.
Помогает обезвреживать некоторые токсические вещества и защищает организм от повреждающего действия радиации.
Является антиоксидантом, причем его антиоксидантное действие усиливается при одновременном приеме витамина С и селена.
Является предшественником глютатиона – вещества, оказывающего защитное действие на клетки печени и головного мозга от повреждения алкоголем, некоторых лекарственных препаратов и токсических веществ, содержащихся в сигаретном дыме.
Показания к применению
Необходимость улучшить состояние кожных покровов,
Ускорение регенерации волос и ногтевых пластинок,
Медленное заживление ран, царапин, ссадин.
В составе комплексной терапии
при анемиях различного происхождения,
болезнях дыхательной системы,
белковом голодании и тяжелых инфекционных болезнях,
болезнях кожи, ломкости волос, алопециях.
Применение аминокислоты противопоказано при цистинурии. Во время беременности и в период грудного вскармливания вещество следует употреблять с осторожностью.
Особенности приема и взаимодействия
Совместное применение цистина и витаминов В 1 и С снижает эффективность инсулина. При сахарном диабете принимать только по назначению врача.
Входит в состав следующих препаратов:
659332, Россия, Алтайский край,
Бийск, ул. Социалистическая, 23/6
119590, Россия, Москва,
ул. Довженко, дом 4, корпус 1
Цистин
Фармакологическое действие
Цистин — некодируемая аминокислота, представляющая собой продукт окислительной димеризации цистеина, в ходе которой две тиольные группы цистеина образуют дисульфидную связь цистина. Цистин содержит две аминогруппы и две карбоксильных группы и относится к двухосновным диаминокислотам.
В организме находятся в основном в составе белков. Обладает антиоксидантным, детоксикационным, гепатотропным, иммуномодулирующим, репаративным, ранозаживляющим, отхаркивающим и муколитическим эффектом. Улучшает состояние кожи, активизируя регенеративные процессы в эпидермисе, волосах, ногтевых пластинках, участвует в клеточном метаболизме и обменных тканевых процессах, активизирует биохимические процессы, укрепляет организм в целом, повышая устойчивость к инфекциям и стрессовым ситуациям.
Фармакокинетика
В ходе обмена цистина образуется серная кислота, которая, взаимодействуя с другими соединениями, способствует детоксикации систем организма.
Показания
Бронхиальная астма, болезнь Альцгеймера, анемия различного генеза, заболевания дыхательной системы (бронхиты и пневмонии), цистит, алкоголизм, для улучшения функции зрения, белковое голодание, тяжёлые инфекционные заболевания в период реабилитации. Отравления солями тяжёлых металлов, атеросклероз, эмфизема, ревматоидный артрит, послеоперационные ожоговые поверхности, заболевания кожи, алопеция, ломкость волос.
Противопоказания
Гиперчувствительность, цистинурия, детский возраст до 11 лет.
С осторожностью
Совместное применение цистина и витаминов B1 и C снижает эффективность инсулина. Поэтому при сахарном диабете данное соединение следует принимать только по назначению врача.
Беременность и грудное вскармливание
Во время беременности и в период грудного вскармливания препарат следует употреблять с осторожностью.
Способ применения и дозы
Режим дозирования индивидуальный, в зависимости от показаний и лекарственной формы.
Побочные действия
Аллергические реакции, высыпания на коже.
Взаимодействие
Сочетание с витамином E взаимно усиливает полезные свойства.
Особые указания
Цистин присутствует в птице, кисломолочных продуктах, овсе, зародышах пшеницы и в содержащих серу продуктах, таких, как яичный желток, чеснок, лук и брокколи.
Классификация
Фармакологические группы
Коды МКБ 10
Поделиться этой страницей
Подробнее по теме
Ознакомьтесь с дополнительной информацией о действующем веществе Цистин:
Лучшее, что вы можете сделать для своего сердца
В течение жизни наше сердце подвергается множеству неблагоприятных факторов, которые в итоге приводят к болезням. Часто изменения в сердце происходят медленно, и потому незаметно, а выявляются случайно, на обследовании или уже при развитии симптомов болезни.
Тогда же начинается и лечение, которое уже не всегда будет эффективным, так как много времени было упущено. При этом важную поддержку своему сердцу вы можете оказать еще до развития заболевания, останавливая патологические изменения в миокарде даже при совокупности неблагоприятных условий.
Глутатион и свободные радикалы
Основным повреждающим фактором на клеточном уровне являются свободные радикалы. Насколько эффективно может бороться с ними собственная система защиты организма зависит в том числе и от исходного состояния здоровья. Они образуются регулярно, но, в зависимости от образа жизни и наличия заболеваний, у кого-то в большем количестве, у кого-то в меньшем. Для нейтрализации свободных радикалов в организме вырабатывается глутатион – это сильный антиоксидант, который мы создаем для себя сами. Он помогает оптимизировать дыхательную цепь митохондрий, предотвращая гибель клеток при нарушении обмена по каким-либо причинам. В миокарде этот процесс наиболее активен: это спасает кардиомиоциты в случае недостатка кислорода. Но эффективность синтеза глутатиона зависит от наличия в организме необходимых для этого аминокислот: глицина, цистеина, глутаминовой кислоты.
Оптимальный источник аминокислот для создания глутатиона
Производство глутатиона в организме в разные периоды может быть различным, что связано с уровнем здоровья и образом жизни, который ведет человек. Поэтому наша идеальная система защиты не всегда оказывается в полной готовности, и закономерно ее активность снижается при хронических нарушениях в органах и тканях. Истощение антиоксидантной системы связано с недостатком необходимых аминокислот: цистеина, глутаминовой кислоты и глицина. Все эти аминокислоты могут синтезироваться в организме, то есть являются заменимыми, но их синтез резко снижается при нарушениях обмена, которые сопровождают острые и хронические заболевания различной этиологии.
Как Элтацин ® действует на организм
Так как глутатион постоянно необходим во всех тканях, прием Элтацина ® оказывает положительное воздействие на весь организм. Его применение в кардиологии позволяет снизить вероятность развития сердечной недостаточности при различных заболеваниях сердца, а также помогает предупредить повреждение миокарда при хирургических вмешательствах.
Элтацин ® помогает оказывать комплексное воздействие при вегетативной дисфункции, действуя при этом на саму причину ее развития – накопление свободных радикалов и несовершенство дыхательной цепи митохондрий. Аминокислоты глицин и глутаминовая кислота обладают ноотропным действием, улучшая при ВСД состояние нервной системы.
Элтацин ® применяется для профилактики развития заболеваний сердца у спортсменов, повышает выносливость, помогает выдерживать неравномерные нагрузки.
Периодическое применение Элтацина ® на фоне общего неблагополучия здоровья помогает легче переносить сезонные изменения, физические и психологические стрессы, позволяет сердцу дольше оставаться здоровым и отодвинуть возрастные процессы в миокарде.
Выпадение волос и микроэлементы
Стержень волоса на 80% состоит из белка, поэтому наш рацион должен содержать достаточное его количество для обеспечения фолликула волоса этим строительным материалом.
Предпочтительными являются белки животного происхождения – они содержат незаменимые аминокислоты, не синтезируемые в организме. Мясо и рыба должны быть обязательно включены в каждодневное питание. Фрукты и овощи будут способствовать профилактике гиповитаминозов, а орехи, сухофрукты и крупы – микроэлементных нарушений. Полезны волосам и коже головы и полиненасыщенные жирные кислоты: в большом количестве они содержатся в рыбьем жире (жирные сорта рыбы – семга, палтус). Дефицит эссенциальных жирных кислот играет важную роль в развитии дерматита волосистой части головы и выпадения волос. Выпадение волос вследствие дефицитных состояний происходит со всей поверхности кожи головы (диффузное выпадение), стержень волоса может стать сухим и тонким, в некоторых случаях меняется и цвет волос, поскольку меланоциты также страдают от нехватки незаменимых жирных кислот. Дисбаланс этих нутриентов чаще всего имеет алиментарную природу и наиболее распространен среди тех, кто потребляет недостаточное количество рыбьего жира и красного мяса. Наиболее важными среди всех эссенциальных жирных кислот считаются омега-3 жирные кислоты (производные линолевой кислоты, присутствуют в красном мясе и овощах) и омега-6 жирные кислоты (производные альфа-линоленовой кислоты, присутствуют в жирной рыбе и морепродуктах). Прием омега-3 и 6 жирных кислот оказывает выраженный эффект при выпадении волос и шелушении кожи головы, возникших вследствие дефицита этих жирных кислот. С пищей необходимо потреблять также минимальное количество холестерина, который входит в состав клеточных мембран и способствует делению клеток.
Для здоровья волос также важны и основные микроэлементы – железо, селен, цинк, кальций, хром, медь, йод, марганец и кремний
Другой микроэлемент, влияющий на здоровье волос, – медь. Медь необходима для усвоения железа. Недостаток меди может косвенно способствовать диффузному выпадению волос за счет снижения всасывания железа. Недостаток этого микроэлемента в рационе питания может также непосредственно влиять и на качество волос. Волосяное волокно становится более тонким и ломким, укорачивается и стадия роста волоса
Еще один важный микроэлемент – цинк. Цинк необходим в производстве волосяного волокна, а дефицит цинка приводит к диффузному выпадению волос на голове и на теле. Вегетарианцы особенно часто имеют дефицит цинка, поскольку основной источник – мясо и рыба. Недостаток этого микроэлемента может наблюдаться и у людей, имеющих хронические заболевания желудочно-кишечного тракта. Следует обратить внимание, что хелатные соединения цинка усваиваются гораздо легче и лучше переносятся по сравнению с неорганическими его соединениями, например. сульфатом цинка.
Трихологи рекомендуют внимательно отнестись к приему витаминных комплексов
Рекомендуется профилактически принимать поливитаминные комплексы, содержащие большие дозы витаминов группы В, биотин, аминокислоты. Это поможет во многих случаях предотвратить выпадение волос или снизить его интенсивность.
К витаминам группы В относятся несколько витаминов, которые похожи по своей молекулярной структуре и деятельности. Эта группа включает в себя B1 (тиамин), В2 (рибофлавин), ниацин (никотиновая кислота), B6 (пиридоксин), В12 (цианокобаламин), фолиевую кислоту, пантотеновую кислоту, и биотин. Из них биотин, вероятно, является наиболее важным для функционирования волосяных фолликулов.
Дефицит биотина способен вызывать воспаление кожи головы, дерматит, который, в свою очередь, может вызывать хроническое выпадение волос. Было отмечено, что прием биотина в течение 2-3 месяцев способствует устранению воспаления кожи головы, устойчивого к другим методам лечения.
Тиамин и другие витамины группы В – это, прежде всего, коферменты важнейших ферментов, обеспечивающих функционирование клетки, особенно митохондрий. Митохондрии – главные внутриклеточные органеллы, производящие молекулы энергии, АТФ. Клетки волосяного фолликула имеют очень высокую степень метаболической активности. Они являются одними из наиболее активных клеток в организме. Этот исключительный уровень активности приводит к тому, что волосяные фолликулы становятся особенно чувствительны к дефициту энергии Включаются в состав комплексов и различные аминокислоты. L – цистеин – природная серо-содержащая аминокислота, структурная основа кератина, содержится в большом количестве в стержне волоса – 15,9%. Известны патологии стержня волос и виды алопеций, связанные с дефицитом L-цистеина (трихотиодистрофия, ВИЧ-ассоциированная алопеция). Еще одна очень важная аминокислота – Л-лизин, ее человек получает в основном из мясной пищи; в связи с этим у людей, не получающих достаточное количество животного белка, может наблюдаться дисбаланс этой аминокислоты. Учеными было установлено, что Л-лизин играет крайне важную роль в абсорбции железа и цинка. 1.5-2.0 г этой аминокислоты способствует более быстрому прекращению выпадения волос у лиц с железодефицитом. Следует отметить, что для достижения большего эффекта Л-лизин рекомендуется принимать вместе препаратами цинка и железа.
Однако не следует полагать, что биодобавки и поливитамины — панацея. Трихологи предпочитают не назначать полимикроэлементные препараты, так как существует определенный антагонизм между составляющими комплекс элементами. Микроэлементы предпочтительно принимать при выявлении их дефицита в организме, учитывая принципы взаимодействия микроэлементов между собой. Например, по анализам выявлен недостаток в организме цинка и переизбыток меди. Прием поливитаминов, содержащих одновременно медь и цинк, усугубит состояние: меди станет еще больше, а цинка — меньше. Если прием микроэлементных комплексов носит профилактический характер, то следует останавливать свой выбор на тех, где учтены принципы синергизма и антагонизма входящих в состав микроэлементов.
Выпадение волос может быть связано и с диетами, к которым часто прибегают женщины. Жировая ткань у женщины — не просто неэстетичная и ненужная, по мнению многих, ткань, а орган, который выполняет гормональную функцию. Если женщина теряет 10% массы тела, не страдая ожирением, а стремясь к навязанным сейчас идеалам, то это, как правило, приводит к белковому дефициту и дисбалансу минералов. Длительный алиментарный дисбаланс может способствовать возникновению острого и хронического диффузного выпадения волос: клетки волосяного фолликула имеют очень высокую скорость деления, что требует адекватного поступления к ним белка, микроэлементов, витаминов, кроме того, чувствительны фолликулы и к дефициту энергии. Выпадение волос, как правило, начинается через несколько месяцев после начала диеты и может сохраняться в течение нескольких месяцев после ее завершения.
Для того чтобы волосы получали достаточное питание, во время каждого приема пищи следует употреблять продукты, богатые витаминами, пищевыми волокнами и протеинами, минеральными веществами, углеводами и микроэлементами. Необходимо помнить, что при длительных сбоях в правильном питании волосы могут потерять свою красоту, начать выпадать, станут безжизненными и тусклыми, с секущимися концами.
Цистиноз: патогенез, клинические проявления и лечение
Цистиноз – это редкое наследственное заболевание, передающееся по аутосомно-рецессивному типу и характеризующееся накоплением цистина в лизосомах клеток различных органов и тканей. Нефропатический цистиноз проявляется синдромом Фанкони, развивающимся в раннем детском возрасте, и в конечном итоге приводит к развитию терминальной хронической почечной недостаточности. В подростковом и старшем возрасте у пациентов с цистинозом развиваются различные внепочечные проявления, в том числе поражение поджелудочной, щитовидной и половых желез, увеличение печени и селезенки и др. Методом выбора почечной заместительной терапии у детей и подростков с цистинозом является трансплантация почки. Сразу после установления диагноза цистиноза всем больным необходимо назначать терапию цистеамином, который уменьшает отложения цистина в лизосомах, и задерживает развитие или прогрессирование хронической почечной недостаточности и внепочечных проявлений цистиноза. В статье на примере двух наблюдений обсуждаются клинические проявления и лечение нефропатического цистиноза.
С.В. Моисеев. Цистиноз – это редкое аутосомно-рецессивное заболевание, которое является одной из основных причин развития синдрома Фанкони у детей. Цистиноз был описан в 1903 г. швейцарским биохимиком Emil Abderhalden, хотя первого ребенка с этим заболеванием наблюдал другой швейцарец Eduard Kaufmann [1]. Пациент умер в возрасте 21 месяца, а на вскрытии в различных органах были обнаружены массивные отложения аминокислоты цистина. Нес колько позднее голландский патологоанатом George Lignac более подробно описал проявления цистиноза [2]. Причиной этого наследственного заболевания являются мутации гена CTNS, кодирующего белок цистинозин, который переносит аминокислоту цистин через мембрану лизосом. Нарушение функции транспортного белка приводит к накоплению и кристаллизации цистина в лизосомах клеток, прежде всего почек, которые поражаются уже на первом году жизни, а также глаз, щитовидной и поджелудочной желез, половых органов, мышц и центральной нервной системы [3]. В 2010 г. в США цистинозом страдали 1,4% детей, получавших лечение диализом, и 2,1% детей, перенесших трансплантацию почки [4]. Цистиноз относится к орфанным заболеваниям. В Австралии и странах Европы, в том числе Франции, Германии, Дании и Швеции, его распространенность среди живых новорожденных варьировалась от 1:192000 до 1:115000, хотя она была в несколько раз выше в некоторых популяциях, например, в Бретани (Франция) и Квебеке (Канада) 5.
Выделяют три формы цистиноза: (1) нефропатическая инфантильная, (2) нефропатическая ювенильная (поздняя, подростковая), (3) ненефропатическая форма взрослых (доброкачественный ненефропатический цистиноз, цистиноз с поражением глаз). Инфантильная нефропатическая форма цистиноза характеризуется тяжелым течением и приводит к развитию терминальной хронической почечной недостаточности в детском возрасте. При ювенильной форме тяжелое поражение почек отмечается позднее (в подростковом возрасте), а при форме взрослых вообще отсутствует. Увеличение выживаемости детей с цистинозом в первую очередь стало результатом почечной заместительной терапии (диализ и трансплантация почки), однако сегодня возможна и патогенетическая терапия цистеамином, который обеспечивает выведение цистина из лизосом и позволяет замедлить прогрессирование патологического процесса, особенно если лечение было начато до развития необратимого поражения внутренних органов.
В.В. Мальцева. К настоящему времени описаны около 120 мутаций гена CTNS, расположенного на хромосоме 17p13.2. В странах Европы и Северной Америки чаще всего встречается делеция 57257 нуклеотидов, которая наблюдается более чем у половины пациентов с цистинозом [10,11]. Данная мутация была выявлена у 14 (42,4%) из 33 российских детей с инфантильным цистинозом [12]. Реже встречались миссенс мутации c.518A>G и c.1015 G>A, которые наблюдались, соответственно, у 6 (18,2%) детей из пяти неродственных семей и 5 (15,2%) пациентов из трех семей. Первая мутация отмечалась в основном в чеченской этнической группе, а вторая – в карачаевской. Более чем у половины детей были выявлены гомозиготные мутации гена CTNS, которые характерны для популяций с высоким процентом близкородственных браков. Семь патогенных мутаций гена CTNS не были описаны ранее [13]. Фенотип цистиноза в значительной степени зависит от типа мутаций гена CTNS. Делеции и другие мутации, сопровождающиеся полным отсутствием функционального белка, вызывают развитие инфантильного цистиноза, в то время как ювенильная и взрослые формы заболевания ассоциированы с более “легкими” мутациями, в частности, миссенс [14]. В российской выборке концентрации цистина в лейкоцитах у пациентов с гомозиготными стоп-кодонами (делеция 57 тыс нуклеотидов, нонсенс мутации c.283G>T, c.433C>T и c.785G>A) были значительно выше, чем у детей с гомозиготными миссенс мутациями (c.518A>G, c.627C>A и c.1015G>A) [12].
С.В. Моисеев. Каковы клинические проявления цистиноза? Когда следует подозревать это заболевание у ребенка/подростка или взрослого?
Н.В. Чеботарева. В зависимости от возраста, когда появляются симптомы цистиноза, и тяжести поражения почек выделяют три клинических варианта заболевания [3,15]. Чаще всего (95% больных) встречается инфантильный нефропатический цистиноз, который характеризуется развитием синдрома Фанкони уже на первом году жизни. Этот синдром, описанный в начале 30-х гг. Fanconi в Швейцарии, de Toni в Италии и Debré во Франции, встречается как у детей, так и взрослых и развивается в результате дисфункции проксимальных почечных канальцев, которая приводит к увеличению экскреции с мочой аминокислот, глюкозы, фосфора, бикарбоната, натрия, калия, кальция, мочевой кислоты и карнитина. Все перечисленные вещества в норме реабсорбируются в этом сегменте нефрона. Реже выявляется дисфункция дистальных канальцев – гипокалиемия в сочетании с гипохлоремическим метаболическим алкалозом и повышенной активностью ренина в плазме, которые могут имитировать синдром Бартера. У детей основными причинами синдрома Фанкона являются наследственные метаболические заболевания, прежде всего цистиноз [16]. Аминоацидурия и глюкозурия не сопровождаются клиническим симптомами, в частности, снижением массы тела, хотя наличие глюкозы в моче при отсутствии гипергликемии является важным диагностическим признаком. Типичные лабораторные отклонения при синдроме Фанкони включают в себя также гипокалиемию, метаболический ацидоз, гипофосфатемию, гипоурикемию и реже гипонатриемию, а клинические проявления – жажду, полидипсию и полиурию, эпизоды дегидратации, задержку роста, мышечную слабость и рахит. Из-за ограниченного количества мочевых маркеров синдрома Фанкони диагноз цистиноза может быть пропущен в течение первых месяцев жизни. Причинами гипофосфатемического рахита, резистентного к лечению витамином D, у детей и остеомаляции у взрослых с цистинозом являются фосфатурия, потеря витамин D связывающего белка с мочой и нарушение конверсии витамина D на фоне снижения активности α1-гидроксилазы в проксимальных почечных канальцах. Протеинурия обычно минимальная и характеризуется потерей с мочой низкомолекулярных белков. Развернутые проявления синдрома Фанкони при цистинозе обычно наблюдаются уже в возрасте 6-12 мес. Позднее отмечается постепенное снижение скорости клубочковой фильтрации (СКФ), которое приводит к формированию терминальной стадии хронической болезни почек в возрасте 7-10 лет. В международном ретроспективном исследовании, которое проводилось у 205 больных цистинозом в 80-х гг. прошлого столетия, т.е. до разработки патогенетической терапии, медиана возраста пациентов на момент “почечной смерти” (смерти от уремии или инициации почечной заместительной терапии) составила 9,2 года [17]. При этом возраст всех больных с терминальной уремией превышал 5 лет. Таким образом, цистиноз необходимо исключать во всех случаях хронической почечной недостаточности у детей и подростков. Непосредственной причиной канальцевой дисфункции при цистинозе считают отложение цистина в клетках почечных канальцев, хотя патогенез ее может быть более сложным [18]. Так, в опытах на knock-out мышах, не экспрессирующих ген CTNS, изменения клеток проксимальных почечных канальцев определялись до кристаллизации цистина [19,20]. Интересно, что кристаллы цистина главным образом откладываются в интерстициальных клетках почек, редко в подоцитах, но не в тубулярных клетках. Некоторые наблюдения свидетельствуют против кристаллизации цистина как основного фактора прогрессирования тубулярной атрофии, так как формирование деформации по типу “шеи лебедя” не сопровождается отложением кристаллов в проксимальном тубулярном эпителии. Кроме того, кристаллы цистина продолжают накапливаться в интерстиции аллотрансплантатов, при этом синдром Фанкони никогда не развивается. Не выявлено достоверной связи между накоплением цистина в интерстиции и прогрессированием интерстициального фиброза. Напротив, фиброз интерстиция и гломерулосклероз развиваются в участках без отложения кристаллов цистина [21].
Полагают, что избыток цистина, попадающего в цитоплазму тубулярных клеток проксимальных канальцев, влияет на метаболизм этих клеток, влечет за собой снижение митохондриального АТФ, глутатиона и усиление оксидантного стресса. Нарушение внутриклеточного метаболизма тубулярного эпителия вызывает массивный апоптоз тубулярных клеток.
Значительно реже инфантильного нефропатического цистиноза встречаются ювенильная и взрослая формы заболевания (5% случаев) [22]. При ювенильном цистинозе поражение почек менее тяжелое, чем при инфантильном варианте, а существенная задержка роста отсутствует. Функция почек ухудшается медленнее, а терминальная уремия развивается в старшем возрасте (от 12 до 28 лет). Основные проявления ювенильной формы цистиноза – протеинурия и нефротический синдром в сочетании с парциальными канальцевыми нарушениями, например глюкозурией, в то время как полный синдром Фанкони развивается редко. Поражение глаз и развитие терминальной почечной недостаточности наступает позже. При цистинозе взрослых почки и другие внутренние органы не поражаются, а единственным симптомом является фотофобия, связанная с отложением кристаллов цистина в роговице [23].
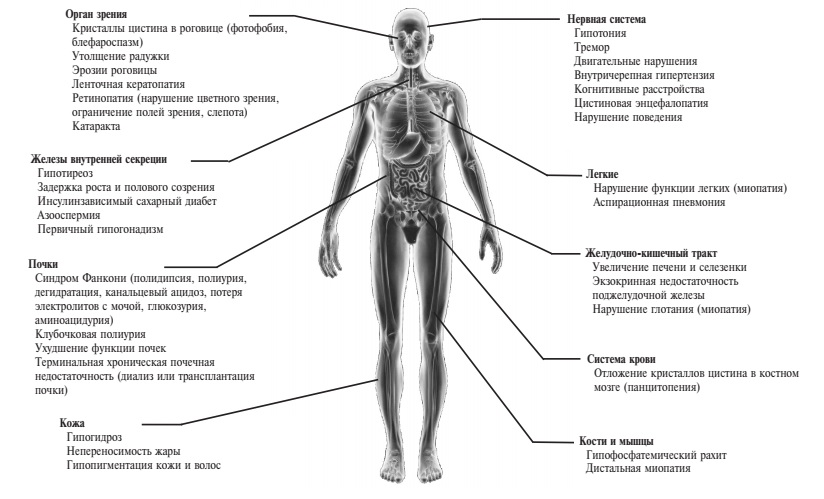
Н.М. Буланов. Цистиноз – это системное заболевание, которое поражает не только почки, но и другие органы и ткани, особенно если пациент не получает патогенетическую терапию [24]. Накопление цистина в лизосомах любых клеток начинается в детском возрасте, однако системные проявления отмечаются позднее нефропатии (рис. 1). Первое внепочечное проявление цистиноза – отложение кристаллов цистина в роговице, которое сопровождается развитием фотофобии и блефароспазма в подростковом или молодом возрасте [25]. К возрасту 16 мес кристаллы цистина определяются в роговице в виде игольчатых опалесцирующих помутнений при осмотре с помощью щелевой лампы у всех пациентов с цистинозом. Цистин может откладываться и в других отделах глазного яблока, в том числе сетчатке, что приводит к слепоте у 10-15% больных [26]. Прогрессирующее накопление и образование кристаллов цистина в фолликулярных клетках щитовидной железы вызывают их атрофию и фиброз и развитие первичного гипотиреоза на втором десятилетии жизни у 50-70% больных цистинозом. Поражение поджелудочной железы при этом заболевании сопровождается нарушением ее экзокринной и эндокринной функции. К возрасту 18 лет у половины пациентов с цистинозом наблюдается постепенное снижение секреции инсулина с развитием сахарного диабета [27]. Примерно у трети больных инфантильным цистинозом отмечается увеличение печени и/или селезенки, хотя функция печени обычно не изменяется. У мальчиков часто развивается первичный гипогонадизм, однако у женщин репродуктивная функция, как правило, сохраняется [28]. Поражение потовых желез приводит к сниженному потоотделению и непереносимости жары. У детей с инфантильным цистинозом, доживших до старшего возраста благодаря почечной заместительной терапии, обычно наблюдаются последствия хронической почечной недостаточности или осложнения длительной иммуносупрессивной терапии после трансплантации почки. Поражение центральной нервной системы является поздним осложнением цистиноза, развивающимся в течение третьего десятилетия жизни. Различают два основных проявления цистиновой энцефалопатии – преобладание мозжечковых и пирамидных нарушений и поражение головного мозга с эпизодами, сходными с острым нарушением мозгового кровообращения. Интеллект у больных цистинозом сохранен, но может наблюдаться изменение нейрокогнитивных функций, таких как зрительная память, внимание, планирование и скорость движений. У детей поражение нервной системы может проявляться синдромом дефицита внимания и трудностями в обучении. Наиболее частыми находками при компьютерной томографии являются атрофия коры головного мозга и кальциноз базальных ганглиев. К поздним жизнеугрожающим осложнениям цистиноза относится вакуольная миопатия, возникающая в результате накопления цистина в мышечных волокнах. Пациенты страдают от прогрессирующей атрофии мышц и снижения мышечной силы. Отмечается атрофия мышц кистей (тенара, гипотенара, межкостных мышц) с характерным положением кисти в виде “когтя”. Наблюдаются симптомы оро-моторной дисфункции, такие как дисфагия, нарушение речи, сиплый голос, отсутствие рвотного рефлекса. Особенно опасно поражение дыхательных мышц с развитием рестриктивной дыхательной недостаточности. В табл. 1 приведена частота различных внепочечных проявлений цистиноза у 100 больных в возрасте от 18 до 45 лет, большинство из которых перенесли трансплантацию почки (92%) [29]. В этом исследовании умерли 33 больных в возрасте в среднем 28,5 лет. Причины смерти включали в себя сепсис (у 9), уремию (у 5), пневмонию (у 4), портальную гипертензию (у 3) и др.
| Проявления | n/N (%) |
|---|---|
| Гипотиреоз | 92/100 (92) |
| Гипогонадизм (у мужчин) | 39/53 (75) |
| Нарушение функции легких | 53/77 (69) |
| Нарушение глотания | 58/97 (60) |
| Миопатия | 50/100 (50) |
| Ретинопатия | 32/100 (32) |
| Инсулинзависимый сахарный диабет | 33/100 (33) |
С.В. Моисеев. В нашей стране самый большой опыт обследования и лечения пациентов с цистинозом накоплен в нефрологическом отделении НМИЦ здоровья детей. Сколько таких больных сегодня наблюдается в отделении? Как проявлялось заболевание?
А.Н. Цыгин. За период с 2008 по 2020 год диагноз нефропатического цистиноза был установлен у 34 детей, в том числе 20 мальчиков (58,8%) и 14 девочек (41,2%). Эти пациенты проживают в 21 субъекте и 7 федеральных округах Российской Федерации. Мини мальный возраст на момент постановки диагноза составил 8 мес, максимальный – 13 лет (медиана 2,2 [1,9; 6,4] года). Наследственный анамнез был отягощен в 6 (17,6%) семьях. У всех детей была выявлена задержка физического развития. На первом году жизни частыми клиническими симптомами были полидипсия (38%), полиурия (38%), глюкозурия (38%), гипокалиемия (29%) и гипофосфатемия (14%). К возрасту 2 лет формирование рахитических изменений нижних конечностей отмечено у 14 (41%) детей. При осмотре с помощью щелевой лампы отложения кристаллов цистина в роговице выявлены в 28 (82%) случаев. Возраст достижения ХБП 3 стадии у 22 (32,4%) пациентов соответствовал 5,2±3,0 годам. В среднем возраст достижения ХБП 5 стадии составил 8,0±2,0 лет. 18 детей (52,9%) достигли терминальной стадии почечной недостаточности. Из них у 12 (35,3%) пациентов выполнена трансплантация почки. У всех сохраняется хорошая функция трансплантата. За период наблюдения умерли 3 (8,8%) детей в возрасте от 6 до 10 лет.
С.В. Рощупкина. Естественное течение инфантильного цистиноза иллюстрирует следующее клиническое наблюдение. Пациентка Л., 34 лет, была госпитализирована в клинику им. Е.М. Тареева в 2019 г. С раннего детского возраста отмечалась задержка роста, а при обследовании выявлен синдром Фанкони – фосфатурия, кальцийурия, глюкозурия, проксимальный канальцевый метаболический ацидоз, гипофосфатемический рахит с гипокальциемией. В возрасте 5 лет отмечено нарушение функции почек, а в 9 лет была начата заместительная почечная терапия в связи с развитием терминальной почечной недостаточности. В 14 лет проведена аллогенная трансплантация почки. С этого же времени отмечает светобоязнь и постепенное снижение зрения. В 24 года при осмотре офтальмологом с помощью щелевой лампы обнаружены отложения кристаллов цистина в роговице. На основании характерного поражения почек и роговицы установлен диагноз цистиноза. Рекомендована патогенетическая терапия цистеамином внутрь и в виде глазных капель. Однако лечение пациентка не получала еще в течение 10 лет после диагностики заболевания. В возрасте 32 лет выявлены гипотиреоз и сахарный диабет с гликемией натощак до 15,6 ммоль/л и повышением содержания гликированного гемоглобина до 8,8%. Начата заместительная терапия L-тироксином и инсулином. Кроме того, отмечено увеличение печени и селезенки. На протяжении всего времени наблюдения сохранялась стабильная, умеренно сниженная функция почечного трансплантата (сывороточное содержание креатинина 160 мкмоль/л, скорость клубочковой фильтрации в пробе Реберга – 41 мл/мин).
В возрасте 33 лет пациентка перенесла острый инфаркт миокарда без подъема сегмента ST. При коронарографии выявлено многоуровневое атеросклеротическое поражение коронарных артерий, в связи с чем проведена чрескожная транслюминальная баллонная ангиопластика со стентированием огибающей артерии. При магнитно-резонансной томографии головного мозга обнаружен кальциноз церебральных артерий.
В возрасте 34 лет при обследовании в клинике отмечались резкое отставание в физическом развитии (рост – 132 см, масса тела – 37 кг), тяжелое поражение органа зрения (помутнение роговицы и полная слепота), декомпенсированный сахарный диабет, гепатоспленомегалия и тромбоцитопения. Диагноз: инфантильный цистиноз с поражением почек (синдром Фанкони, аллогенная трансплантация почки), органа зрения (трофические язвы, кальцинаты роговицы, атрофия зрительного нерва, слепота), поджелудочной железы (инсулинзависимый сахарный диабет), щитовидной железы (гипотиреоз), центральной нервной системы (атеросклероз, кальциноз церебральных артерий), инфаркт миокарда передней стенки левого желудочка без подъема сегмента ST, атеросклероз коронарных артерий, баллонная ангиопластика со стентированием огибающей артерии. Начата терапия цистеамином в дозе 50 мг/кг/сут с удовлетворительной переносимостью.
А.Н. Цыгин. В представленном наблюдении у пациентки с раннего детского возраста определялись задержка роста и проявления синдрома Фанкони, в том числе гипофосфатемический рахит, а в возрасте 9 лет была начата почечная заместительная терапия. Цистиноз может быть выявлен по крайней мере у каждого пятого ребенка с синдромом Фанкони и примерно у каждого двадцатого ребенка с терминальной уремией, нуждающегося в почечной заместительной терапии. Однако этот диагноз не обсуждался даже после появления еще одного характерного симптома цистиноза – светобоязни, связанной с накоплением кристаллов цистина в роговице. Цистиноз был диагностирован только в возрасте 24 лет, т.е. спустя более 20 лет после появления первых симптомов заболевания, когда при осмотре с помощью щелевой лампы были выявлены отложения цистина в роговице. Как указано выше, у всех больных инфантильным цистинозом кристаллы цистина определяются в роговице уже к возрасту 1,5 лет. К сожалению, пациентка на протяжении 10 лет после установления диагноза не получала патогенетическую терапию цистеамином в связи с отсутствием препарата в Российской Федерации. На этом фоне отмечалось прогрессирование заболевания с развитием слепоты, инсулинзависимого сахарного диабета, гипотиреоза, увеличения печени и селезенки. Сходные данные приводят и другие авторы. D. Theodoropoulos и соавт. проанализировали течение цистиноза у 36 взрослых пациентов с инфантильным цистинозом (максимальный возраст 36 лет) [30]. Все больные перенесли трансплантацию почки в возрасте от 5 до 19 лет. Только 11 из них получали адекватную терапию цистеамином. Семь (19%) из 36 больных умерли. У большинства пациентов наблюдались тяжелые проявления цистиноза, в том числе слепота (14%), гипотиреоз, требующий заместительной терапии L-тироксином (85%), и инсулинзависимый сахарный диабет (14%). При этом результаты трансплантации почки у больных цистинозом считают очень хорошими. C. Cohen и соавт. сопоставили отдаленные исходы трансплантации почки у 30 взрослых пациентов с цистинозом и 93 больных контрольной группы, подобранных по возрасту и ряду других показателей [31]. В основной группе трансплантация была выполнена в возрасте от 7 до 36,5 лет (медиана – 20,4 года). К этому времени у всех больных имелись отложения цистина в роговице, у 3 – сахарный диабет, у 7 – гипотиреоз. Выживаемость трансплантата у больных цистинозом была выше, чем в контрольной группе (р=0,013), а многофакторный анализ подтвердил, что наличие этого заболевания ассоциируется со снижением риска отторжения трансплантата (отношение рисков 0,11; 95% доверительный интервал 0,020,61). Частота посттрансплантационного сахарного диабета в основной группе была выше, чем в контрольной (13,0% и 5,0%), однако различия не достигли статистической значимости. Высокую выживаемость трансплантата демонстрирует и наше наблюдение 34летней пациентки с цистинозом, перенесшей трансплантацию почки около 20 лет назад. Следует подчеркнуть, что синдром Фанкони в трансплантате никогда не рецидивирует [15]. Соответственно, трансплантацию почки считают методом выбора почечной заместительной терапии у детей с цистинозом. Синдром Фанкони иногда сохраняется после начала диализа или трансплантации почки, что в редких случаях требует удаления нативных почек вследствие чрезмерных потерь жидкости и электролитов [32].
С.В. Моисеев. Как объяснить развитие острого коронарного синдрома у молодой женщины? Поражаются ли коронарные артерии при цистинозе?
Н.В. Чеботарева. Несмотря на молодой возраст, пациентка в течение около 30 лет страдает хронической болезнью почек, которая ассоциируется с увеличением риска сердечно-сосудистых исходов у пациентов не только старшего, но и молодого возраста. В крупном американском исследовании были проанализированы частота госпитализаций по поводу сердечно-сосудистых заболеваний и сердечно-сосудистая смертность более чем у 33000 молодых пациентов с терминальной стадией хронической болезни почек, начавших почечную заместительную терапию (гемодиализ, перитонеальный диализ или трансплантация почки) в возрасте 1-11, 1221 и 21-29 лет [33]. Во всей выборке доля сердечнососудистых причин в структуре общей смертности составила 37,7% и была выше всего в группе пациентов в возрасте 21-29 лет (39,1%). Риск сердечно-сосудистой смерти увеличивался с возрастом и у молодых людей был достоверно выше, чем у подростков и детей. Кроме того, факторами, ассоциировавшимися с повышенным риском смерти от сердечно-сосудистых заболеваний, были женский пол и низкий индекс массы тела, а также различные сопутствующие заболевания, в частности сахарный диабет, в то время как трансплантация почки ассоциировалась с улучшением сердечно-сосудистых исходов по сравнению с лечением диализом. Таким образом, развитие острого коронарного синдрома у молодой женщины с цистинозом не было неожиданным, учитывая большую длительность почечной заместительной терапии, наличие умеренной дисфункции почечного трансплантата и дополнительных факторов риска, таких как низкий индекс массы тела и сахарный диабет.
В.В. Мальцева. У взрослых пациентов с цистинозом нередко определяется кальциноз артерий. В крупном исследовании у 100 больных в возрасте от 18 до 45 лет частота его составила 31%, а кальцинаты в ткани головного мозга определялись в 22% случаев [29]. M. Ueda и соавт. выявили кальциноз сосудов с помощью компьютерной томографии после трансплантации почки у 32% из 41 пациента с цистинозом [34]. У большнства больных кальцинаты локализовались в коронарных артериях. Одному пациенту было выполнено аортокоронарное шунтирование трех артерий в возрасте 25 лет. Паценты с кальцинозом артерий были старше и чаще страдали сахарным диабетом. Частота кальциноза увеличивалась, если пациенты длительно не получали цистеамин. При этом длительность лечения диализом не отличалась между группами больных, у которых определялись и не определялись отложения кальция в стенках артерий. Эти данные могут указывать на роль цистина в развитии кальциноза артерий при цистинозе. Дополнительным фактором риска сердечно-сосудистых исходов у пациентов с цистинозом может быть также гиперхолестеринемия, которая нередко встречается при этом заболевании [35].
С.В. Моисеев. В представленном наблюдении диагноз цистиноза был установлен на основании клинической картины и результатов офтальмологического исследования. Достаточно ли этих данных?
Н.М. Буланов. У нашей пациентки диагноз цистиноза, конечно, не вызывает сомнения, учитывая наличие типичных клинических проявлений, включая тяжелое поражение почек, развившееся в детском возрасте, низкий рост, изменения со стороны органа зрения (в частности светобоязнь), инсулинзависимый сахарный диабет и гипотиреоз. Наличие кристаллов цистина в роговице подтверждает этот диагноз, так как отложения цистина не обнаруживаются при других заболеваниях, сопровождающихся синдромом Фанкони, в том числе тирозинемии, галактоземии, гепаторенальном гликогенозе, болезни Дента, синдроме Лове и т.д. [15]. У детей и подростков осмотр роговицы с помощью щелевой лампы является доступным скрининговым методом диагностики, хотя исследование должно проводиться опытным офтальмологом. Необходимо также учитывать
Е.Ю. Андреева. Приводим еще одно наблюдение цистиноза у 23-летнего мужчины. В возрасте 1 года развился синдром Фанкони, проявлявшийся проксимальным канальцевым гиперхлоремическим метаболическим ацидозом, бикарбонатурией, калийурией, гипокалиемией, кальциурией, фосфатурией. В 7 лет в связи с появлением светобоязни пациент был осмотрен офтальмологом. С помощью щелевой лампы выявлены характерные отложения кристаллов цистина в роговице. Отложения цистина были обнаружены также в интерстиции почки при гистологическом исследовании нефробиоптата. При молекулярно-генетическом исследовании в лаборатории генетики и клеточной биологии НМИЦ здоровья детей выявлена мутация гена CTNS, подтверждавшая диагноз цистиноза. Патогенетическая терапия не проводилась. В 12 лет в связи с развитием терминальной почечной недостаточности выполнена аллогенная трансплантация почки от матери. Непосредственно после трансплантации начата патогенетическая терапия цистеамином (Цистагон 50 мг/кг/сут) внутрь и в виде глазных капель (Цистадропс 1 мл/сут) с хорошей переносимостью. Наблюдался в отделении нефрологии НМИЦ здоровья детей. В 16 лет диагностирован сахарный диабет – уровень гликемии натощак составлял 8,8 ммоль/л (HbA1c – 7,7%). Впервые обследован в клинике им. Е.М. Тареева в возрасте 23 лет. Рост 165 см, масса тела 72 кг. Функция щитовидной железы и острота зрения не снижены. Сохраняется хорошая функция трансплантата (сывороточный уровень креатинина – 124 мкмоль/л, СКФ в пробе Реберга – 75 мл/мин). Пациент продолжает терапию цистеамином. Диагноз: инфантильный цистиноз с поражением почек (синдром Фанкони, аллогенная трансплантация почки от матери), органа зрения (кератопатия, отложение кристаллов в роговице) и поджелудочной железы (сахарный диабет).
О.Н. Науменко. Как и первый случай, представленное наблюдение иллюстрирует типичные ранние проявления инфантильного цистиноза – синдром Фанкони, развившийся в возрасте 1 года, и светобоязнь, появившаяся в возрасте 7 лет. Диагноз был подтвержден результатами осмотра с помощью щелевой лампы, биопсии почки и молекулярно-генетического исследования. Концентра цию цистина в лейкоцитах не измеряли, так как этот метод в нашей стране начали использовать позднее. Функция почечного трансплантата у пациента остается хорошей на протяжении более 10 лет. Через 4 года после трансплантации почки развился сахарный диабет, однако другие внепочечные проявления цистиноза отсутствуют (нормальный рост, не определяются кристаллы цистина в роговице, не снижена функция щитовидной железы), что, несомненно, отражает эффективность длительной терапии цистеамином. Нельзя также исключить вклад иммуносупрессивной терапии глюкокортикостероидами и такролимусом в развитие сахарного диабета.
Н.В. Чеботарева. Ранняя диагностика цистиноза имеет очень важное значение, так как патогенетическая терапия цистеамином улучшает рост у детей и задерживает развитие терминальной хронической болезни почек и большинства внепочечных проявлений заболевания. Цистеамин проникает в лизосомы, расщепляет цистин на две молекулы и соединяется с одной из них с помощью дисульфидного мостика. Цистеин и цистеинциастеаминовый комплекс не нуждаются в цистозине для выхода из лизосом, так как они транспортируются белком PQLC2. Лечение цистеамином, которое следует начинать сразу после установления диагноза цистиноза, не только предупреждает дальнейшее накопление цистина, но и вызывает выведение его из лизосом клеток. Цистеамин производится в виде битартрата для приема внутрь под коммерческим названием Цистагон, а также в виде капель (0,55% раствор цистеамина гидрохлорида). Капли применяют для растворения кристаллов цистина в роговице, так как пероральная терапия цистеамином не оказывает на них влияние. Эффективность местной терапии каплями цистеамина подтверждена при мета-анализе 7 исследований, в том числе двойных слепых, плацебо-контролируемых [37]. H. Liang и соавт. проанализировали отдаленные результаты лечения глазными каплями цистеамина (в среднем 3,3 раза в день) в течение до 45 мес у 130 больных цистинозом [38]. Применение препарата позволяло поддерживать нормальную остроту зрения и вызывало уменьшение количества кристаллов цистина в роговице. Светобоязнь уменьшалась в течение 3 мес. Нежелательные реакции включали в себя преходящее раздражение, покалывание и туман перед глазами. В отдельных случаях развивались кератит и язвы роговицы, однако они могли быть связаны с основным заболеванием.
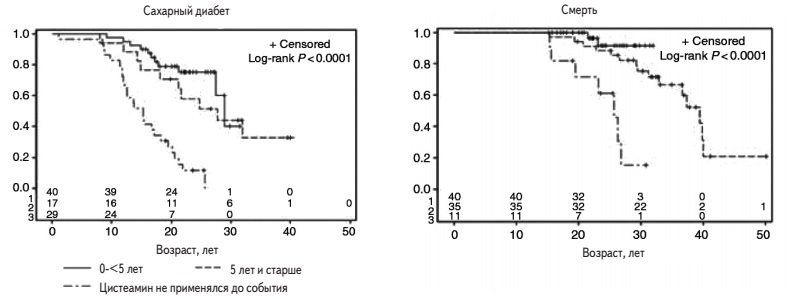
Пероральная терапия цистемином не влияет на течение синдрома Фанкони, однако позволяет задержать развитие терминальной хронической почечной недостаточности на 6-10 лет [3]. Кроме того, она предупреждает или тормозит развитие внепочечных проявлений цистиноза. В когортном исследовании у больных, продолжавших терапию цистеамином более 20 лет, частота сахарного диабета и миопатии снизилась с 28% до 0% и с 60% до 0%, соответственно, а у больных, получавших препарат в течение более 8 лет, частота гипотиреоза снизилась с 87% до 56% [29]. Длительность терапии цистеамином в этом исследовании у 33 умерших пациентов составила 2,1±0,7 года, а у 67 выживших больных – 9,6±0,9 года. Brodin-Sartorius и соавт. изучали эффективность цистеамина в ретроспективном исследовании у 86 взрослых больных (средний возраст 26,7 лет) [39]. 75 из них получали препарат в течение в среднем 17,4 лет. Терапия цистеамином, начатая в возрасте до 5 лет, значительно задерживала развитие терминальной хронической болезни почек, а также гипотиреоза, сахарного диабета и нейромышечных нарушений. У пациентов, начавших лечение после 5 лет, сроки развития сахарного диабета и гипотиреоза, значительно увеличились по сравнению с таковыми у нелеченных пациентов (рис. 2). Кроме того, терапия цистеамином привела к увеличению продолжительности жизни больных цистинозом. Полученные данные свидетельствуют о том, что пероральную терапию цистеамином лучше начинать в раннем детском возрасте, однако она обоснована и в более поздние сроки после установления диагноза, в том числе у взрослых пациентов, у которых лечение по крайней мере позволяет избежать дальнейшего ухудшения состояния. Для контроля эффективности терапии цистеамином целесообразно определять концентрацию цистина в лейкоцитах, которая не должна превышать 1 нмоль 1/2 цистина на мг белка [40].
Е.А. Тао. Все больные цистинозом нуждаются в симптоматической терапии, которая включает в себя восполнение потерь электролитов и жидкости при синдроме Фанкони, применение витамина D при рахите, рекомбинантного гормона роста при задержке роста, тестостерона при гипогонадизме, гормонов щитовидной железы при гипотиреозе, инсулина при сахарном диабете и т.п. [41,42]. Ведение детей с синдромом Фанкони может представлять большие трудности, учитывая значительную потерю электролитов на фоне выраженной полиурии и частой рвоты. В 1982 г. G. Hay cock и соавт. описали 3 детей с цистинозом, у которых индометацин уменьшал полиурию и клинические симптомы [43]. Позднее уменьшение полиурии (на 30-70%) и увеличение прибавки массы тела при лечении индометацином было отмечено и другими авторами [42]. Индометацин ингибирует синтез простагландинов в паренхиме почек, которые увеличивают почечный кровоток, подавляют реабсорбцию хлорида натрия и снижают экспрессию аквапорина 2. Таким образом, индометацин усиливает реабсорцию соли в петле Генле и собирательных канальцах. У здоровых людей препарат не оказывает существенного влияния на СКФ, однако он может вызвать ее снижение у пациентов с нарушенной перфузией почек, так как уве личение продукции простагландинов является компенсаторным механизмом, направленным на поддержание функции почек. Кроме того, индометацин может оказывать токсическое действие на интерстиций почек. В целом индометацин считают относительно безопасным у детей с почечным синдромом Фанкони, однако препарат следует отменить в случае развития дегидратации, артериальной гипотонии или ухудшения функции почек [42]. Ингибиторы АПФ и блокаторы ангиотензиновых рецепторов широко используются для замедления темпа снижения СКФ у пациентов с заболеваниями почек, особенно сопровождающимися протеинурией. Высказано предположение о том, что они могут быть использованы и у детей с нефропатическим цистинозом [44]. Однако эффективность блокаторов ренин-ангиотензиновой системы у таких больных не доказана. Более того, они могут ухудшить перфузию почек, которая обычно снижена у больных с синдромом Фанкони. В связи с этим применять подобные препараты у пациентов с цистинозом следует с осторожностью.
С.В. Моисеев. Важное значение для своевременной диагностики цистиноза, как и любых других редких заболеваний, имеет настороженность врачей, прежде всего педиатров нефрологов. Как показывают наши наблюдения, этот диагноз устанавливают поздно несмотря на наличие типичных проявлений заболевания. Цистиноз следует исключать у всех детей с синдромом Фанкони, а также у больных с терминальной уремией, развивающейся в детском или подростковом возрасте. Подтвердить наличие цистиноза относительно несложно. В качестве скринингового метода диагностики можно использовать осмотр роговицы с помощью щелевой лампы. Высокочувствительными и специфичными диагностическими методами являются измерение концентрации цистина в лейкоцитах и молекулярногенетическое исследование. Всем больным цистинозом показана пожизненная терапия цистеамином для профилактики развития или прогрессирования инвалидизирующих проявлений заболевания.



