Иммунохимическое исследование белков сыворотки крови и мочи что это
Иммунохимическое исследование белков сыворотки крови и мочи что это
Прямыми показаниями к иммунохимическому исследованию принято считать клинические и лабораторные признаки, которые могут быть проявлением как непосредственно В-клеточных лимфопролиферативных заболеваний (в первую очередь парапротеинемических гемобластозов), так и связанной с ними белковой патологии.
Один из самых частых лабораторных признаков, заставляющих предположить наличие парапротеинемии, — повышение СОЭ (особенно не связанное с реактивными состояниями и другими очевидными причинами), которое в данном случае является результатом увеличения глобулиновой фракции сыворотки крови за счет моноклонального иммуноглобулина. Следует отметить, что белок Бенс-Джонса, который является микроглобулином, не отражается на уровне СОЭ, что в части случаев вызывает диагностические затруднения и неоправданный отказ от исследований для выявления моноклональной секреции.
Другой широко известный симптом парапротеинемии — повышение уровня общего белка сыворотки крови за счет фракции глобулинов. Необходимо помнить, что это не абсолютный признак и связан он с далеко зашедшим заболеванием, когда масса опухоли значительна. Выраженные поликлональные гипергаммаглобулинемии характеризуются такой же биохимической картиной.
Еще одно проявление парапротеинемии — синдром гипервязкости. Его развитие обусловлено не только общим содержанием М-компонента, но и качеством моноклонального иммуноглобулина: высокомолекулярные парапротеины (IgM, полимерный IgA), а также белки, склонные к образованию крупных циркулирующих агрегатов (например, моноклональный IgG3), наиболее часто приводят к появлению гипервязкости. Описаны единичные случаи развития синдрома гипервязкости при миеломе Бенс-Джонса к-типа. В этих случаях моноклональные L-цепи проявляли необычную способность к агрегации, образуя комплексы с молекулярной массой до нескольких миллионов дальтон.
Такие состояния, как упорная протеинурия, особенно в отсутствие клеточного осадка, острая или хроническая почечная недостаточность, могут быть первыми симптомами секреции белка Бенс-Джонса. При этом отсутствуют такие привычные признаки миеломной болезни, как повышение СОЭ и гиперпротеинемия, а протеинурия может быть минимальной и ошибочно оценивается как проявление пиелонефрита. В таких случаях диагностика очень сложна, тем более что пациенты этой группы, как правило, попадают под наблюдение гематолога поздно, а в основном находятся на лечении в нефрологических отделениях.
При клинических проявлениях холодовой гемагглютинации пациент должен быть обследован на наличие моноклонального макроглобулина, практически всегда к-типа, проявляющего антительную активность по отношению к I-антигену мембраны эритроцитов. Оптимум активности этих антител приходится на температуру ниже температуры тела, чем и объясняются особенности клинической картины этого заболевания. Синтез моноклональных Холодовых агглютининов может быть связан с лимфопролиферативным процессом. В таких случаях секреция, как правило, очень незначительна и при рутинном исследовании в биохимической лаборатории обычно не выявляется.
Наличие клинических и лабораторных признаков криоглобулинемии должно насторожить в отношении моноклональной секреции, поскольку почти в половине случаев криоглобулинемия зависит от присутствия парапротеина в сыворотке крови. Тяжесть клинической симптоматики обусловливается не столько концентрацией криоглобулина, сколько температурой осаждения. В то же время установлено, что при повышении концентрации криоглобулинов температура криопреципитации может повышаться, приближаясь к температуре тела.
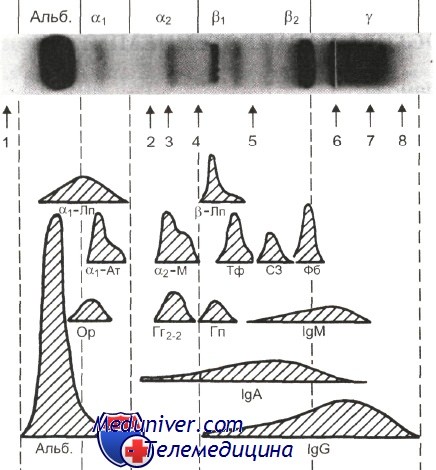
1 — преальбумин; 2 — антихимотрипсин; 3 — церулоплазмин; 4 — фибронектин; 5 — С4 (4-й компонент комплемента); 6 — старт; 7 — С-реактивный белок; 8 — лизоцим; Альб. — альбумин; a1-Лп — а1-липопротеин; а1-Ат — а1,-антитрипсин; Ор— орозомукоид; a2-М — а2-макроглобулин; Гг2„, — гаптоглобин 2—2; р-Лп — р-липопротеин; Тф — трансферрин; Гп — гемо-пексин; C3 — 3-й компонент комплемента; Фб — фибриноген. Анод слева.
Криоглобулинемия I типа выявляется главным образом при миеломной болезни или макроглобулинемии Вальденстрема. Симптоматика связана с отложением криопреципитата в основном в сосудах кожи, что приводит к развитию геморрагического или язвенно-геморрагического васкулита, синдрома Рейно. Криоглобулинемия II типа, при которой парапротеин обладает активностью ревматоидного фактора, ассоциируется с лимфомами, хроническим лимфолейкозом, макроглобулинемией Вальденстрема, миеломной болезнью. Кроме того, она может быть связана с инфицированием вирусом гепатита С или В. Среди клинических проявлений отмечаются характерные признаки иммунокомплексной патологии: васкулит, артрит, гломерулонефрит.
В ряде случаев первым и некоторое время единственным проявлением заболевания, сопровождающегося моноклональной секрецией, может быть развитие AL-амилоидоза с характерной для него клинической картиной. В состав амилоида данного вида входят моноклональные L-цепи или их вариабельные районы (VL), причем преобладают Х-цепи, которые встречаются приблизительно в 2 раза чаще, чем к-цепи. Именно в составе амилоида была идентифицирована новая подгруппа Х-цепей (XVI), которая особенно часто является причиной развития AL-амилоидоза.
При исследовании аминокислотного состава амилоида и белков-предшественников обнаружено замещение части гидрофильных аминокислотных остатков в консервативной области вариабельных доменов на гидрофобные, что сказывается на ухудшении растворимости белка и склонности к образованию агрегатов. Присущая таким белкам «амилоидогенность» была продемонстрирована в опытах in vivo: при введении мышам очищенных белков Бенс-Джонса, полученных от больных с амилоидозом, развивался типичный амилоидоз, причем в состав амилоида входили введенные моноклональные L-цепи.
Типичным показанием к проведению иммунохимического исследования являются остеодеструкции плоских костей, особенно единичные и труднодоступные для биопсии.
Неясные по происхождению плазмоцитозы костного мозга, особенно при умеренном повышении содержания плазматических клеток, также нуждаются в иммунохимической характеристике при проведении дифференциальной диагностики.
Подозрение на наличие М-градиента при рутинном лабораторном исследовании (ЭФ в биохимической лаборатории) должно служить поводом для развернутого иммунохимического исследования, учитывая рассмотренные ранее случаи возникновения ложных М-градиентов.
Частые инфекции легких, верхних дыхательных путей, мочеполовой системы (иногда в дебюте заболеваний, связанных с В-клеточной пролиферацией) следует расценивать как проявление вторичной гипогаммаглобулинемии. Ее генез сложен и связан как со снижением количества нормальных В-клеток, так и с нарушением межклеточных взаимодействий, регулирующих синтез иммуноглобулинов. При рецидивирующих, плохо поддающихся лечению инфекционных осложнениях пациент нуждается как минимум в оценке уровня сывороточных иммуноглобулинов.
Кроме того, перед назначением заместительной терапии препаратами у-глобулинов, особенно вводимыми внутривенно, при любых заболеваниях необходимо исследование сывороточных иммуноглобулинов для исключения первичного селективного IgA-дефицита. Этот самый распространенный из первичных гуморальных иммунодефицитов (частота в популяции достигает 1:700) в ряде случаев протекает бессимптомно. Повторное введение таким больным препарата у-глобулина, содержащего чужеродный для них белок IgA, приводит к развитию выраженных реакций.
Иммунохимические исследования периодически проводят в ходе лечения больных парапротеинемическими гемобластозами и с другими секретирующими В-клеточными опухолями для оценки эффективности лечения, а также пациентам с моноклональными гаммапатиями неясного генеза (МГНЗ).
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Иммунохимическое исследование белков сыворотки крови и мочи что это
Порядок сдачи иммунохимического анализа
Расписание приема анализов и выдачи результатов
Прием анализов и посылок:
Выдача результатов:
Готовность анализа — 10 рабочих дней.
Тел. единой справочной службы: +7 (800) 775-05-82, +7 (495) 612-45-51.
E-mail лаборатории: gammopat@blood.ru
Требования к сбору образцов для иммунохимического анализа
Кровь берется натощак в объеме 8 мл в пробирку для получения сыворотки (пробирка с активаторами свертывания крови, не ЭДТА, не гепарин). Не следует принимать пищу примерно за 6—10 часов до исследования, пить воду можно.
Мочу необходимо собирать в течение 24 часов на обычном питьевом режиме. При этом банку с мочой хранить в прохладном месте. Утром в 6—8 часов освободить мочевой пузырь (эту порцию мочи выливают). Затем в течение суток собирать всю мочу в чистый сосуд емкостью не менее 2 литров. Последняя порция берется точно в то же время, когда накануне был начат сбор (в 6—8 часов). Количество суточной мочи измерить мерным стаканом, отлить 10—50 мл в чистый пластиковый контейнер и доставить в лабораторию НМИЦ гематологии. Обязательно указать объем суточной мочи.
При пересылке образцов по почте или курьером необходимо знать, что на иммунохимический анализ высылается сыворотка крови в объеме 2—4 мл (цельная кровь пересылке не подлежит!) и моча в объеме 10 мл (из суточного объема с указанием суточного количества мочи). Все образцы должны быть подписаны и доставлены в пластиковом флаконе или пробирке с надежно закрывающейся крышкой. При опрокидывании флакона крышка должна держаться на своем месте и жидкость не должна выливаться через щели между крышкой и горлышком емкости. Время от взятия крови до доставки в лабораторию НМИЦ гематологии не должно превышать 2 суток, пересылка при этом осуществляется при температуре +4°…+10°С в специальных термоконтейнерах.
Необходимые документы для проведения исследования
2. Направление от врача.
Анализы на возмездной (коммерческой) основе принимаются только с направлением, содержащим следующие сведения:
При оплате безналичным способом медицинских услуг и отправке в НМИЦ гематологии биоматериала для лабораторных исследований кроме этого направления необходимо прикладывать следующие сопровождающие документы:
При отсутствии этих документов анализы не могут быть сделаны.
Иммунохимическое исследование белков сыворотки крови и мочи что это
Данный тест предназначен для обнаружения моноклонального иммуноглобулина (парапротеина) с помощью сочетания таких методов, как клинический электрофорез и иммунофиксация. В результате разделения белков сыворотки крови путем электрофореза парапротеин (также его называют М-пиком Или М-градиентом) претерпевает миграцию в виде компактной полосы, что делает его заметным на фоне других белков фракций. Метод иммунофиксации позволяет достоверно выявить моноклональный иммуноглобулиновый компонент и определить его абсолютное содержание в сыворотке крови.
Электрофоретическое разделение белков сыворотки крови, клинический электрофорез и иммунофиксация, скрининг болезни Рустицкого-Калера, скрининг миеломы, скрининг миеломатоза, скрининг ретикулоплазмоцитоза, скрининг генерализованной плазмоцитомы.
Синонимы английские
Какой биоматериал можно использовать для исследования?
Как правильно подготовиться к исследованию?
Общая информация об исследовании
Диагностика миеломной болезни проводится с помощью симбиоза двух методов исследования – клинического электрофореза и иммунофиксации – и заключается в выявлении присутствия парапротеина в сыворотке крови для его последующего типирования. С помощью данного исследования можно выявить не только миеломную болезнь, но и другие лимфопролиферативные заболевания, а также амилоидоз, полинейропатию, гемолитические анемии, криоглобулинемию, поражения почек.
Основным признаком данных заболеваний с точки зрения лабораторной диагностики является увеличение синтеза иммуноглобулина. Метод электрофореза позволяет разделить белки сыворотки крови и выделить иммуноглобулин – в результате расщепления он выделяется на фоне других белковых фракций в виде мигрирующей полосы. Этот иммуноглобулин называется парапротеином (также его называют моноклональным иммуноглобулином, М-пиком или М- градиентом). Именно он является онкомаркером при наличии у пациента гематоонкологических заболеваний.
Клинические проявления миеломной болезни связаны с разрушением костей – это могут быть патологические переломы, боли в костях, анемический синдром, снижение гемоглобина в крови, синдром гипервязкости, тромбозы и кровотечения. Разрушение костей приводит к увеличению количества кальция в крови, что в свою очередь влечет за собой кальциевые отложения в почках, легких и на слизистой желудка. Также при миеломной болезни наблюдаются частые бактериальные инфекции у пациента – это связано с падением количества нормальных иммуноглобулинов и нарушениями процесса образования антител.
Наличие множественной миеломы напрямую связано с пролиферацией плазмацитов, способных секретировать парапротеин или его фрагменты. На момент диагноза концентрация моноклонального иммуноглобулина в сыворотке крови чаще всего превышает 25 г/л. Контроль и наблюдение за изменением уровня концентрации парапротеина позволяет проводить мониторинг состояния пациента и оценку эффективности лечения миеломы. При наличии заболевания контрольные анализы для наблюдения за изменением уровня концентрации парапротеинана на фоне терапии должны проводиться каждые 3 месяца.
При миеломе парапротеин в сыворотке крови в 60 % случаев представлен IgG, 20 % приходится на IgA. Эти 20 % относятся к определению миеломы Бенс-Джонса – в этом случае необходимо также проконтролировать продукцию свободных легких цепей (каппа или лямбда) и их наличие в моче. Достаточно редко (в 2–4 % случаев) при наличии миеломы может также отмечаться присутствие биклонального парапротеина.
Лимфома, при которой активно продуцируется моноклональный IgM, называется макроглобулинемией Вальденстрема. При данном типе лимфомы опухолевые клетки диффузно распределяются в селезенке, костном мозге и лимфоузлах. Увеличивается вязкость крови и проявляется ряд клинических симптомов: слепота, спутанность сознания, склонность к кровоточивости, гипертензия, сердечная недостаточность – это связано с повышением концентрации моноклонального IgM до 30 г/л и более. При других типах лимфомконцентрация парапротеинов класса IgM обычно не превышает 30 г/л, хотя они и обнаруживаются у 20 % пациентов.
Помимо перечисленного, моноклональный парапротеин может быть обнаружен при некоторых неопухолевых заболеваниях. Это может быть эссенциальная криоглобулинемия, парапротеинемическая хроническая полинейропатия, холодовая гемолитическая анемия, АL-амилоидоз почек и внутренних органов, болезнь отложения легких цепей. Также парапротеин в сыворотке крови обнаруживается при болезни Кастелмана, POEMS-синдроме и микседематозном лишае.
В случае если парапротеинемия не прогрессирует во множественную миелому или другое заболевание в течение 5 лет, речь идёт о доброкачественной парапротеинемии. В этом случае концентрация парапротеина обычно ниже 3 г/л.
Согласно статистике, парапротеинемия чаще всего выявляется у пациентов старше 50 лет. У лиц старше 65 лет выявляемость заболевания достигает 4-10 %. В большинстве случаев это бессимптомные моноклональные гаммапатии невыясненного значения (МГНЗ) – это парапротеинемия без других признаков онкогематологического заболевания. В этом случае не требуется постоянный мониторинг концентрации.
При выявлении парапротеинемии у пациентов моложе 50 лет необходимо проводить контрольные повторные обследования. Это связано с повышенным риском развития множественной миеломы. В случае обнаружения концентрации парапротеина выше 15 г/л необходимо провести ряд дополнительных исследований: электрофорез 24-часового образца мочи и иммунофиксация каждые 3-6 месяцев.
Для чего используется исследование?
Что означают результаты?
Референсные значения: парапротеина (IgG, A, M, каппа/лямбда) не обнаружено.
Парапротеин в сыворотке крови присутствует в случае наличия у пациента:
Отсутствие парапротеина в сыворотке крови позволяет практически полностью исключить вероятность диагноза «гаммапатия» (для подтверждения необходимо исключить присутствие белка Бенс-Джонса в моче).
Интерпретация результатов исследования не является диагнозом и содержит информацию для лечащего врача для использования информации наряду с другими источниками (анамнеза, истории болезни, других исследований).
Кто назначает исследование?
Онколог, терапевт, гематолог, нефролог, уролог.
1. Лапин С.В. Тотолян А.А. Иммунологическая лабораторная диагностика аутоиммунных заболеваний. Издательство»Человек», СПб- 2010.
2. Tietz Clinical guide to laboratorytests. 4-th ed. Ed. Wu A.N.B.- USA,W.B Sounders Company, 2006,1798 p.
3. Conrad K, Schlosler W., Hiepe F., Fitzler M.J. Autoantibodies in Organ Specific Autoimmune Diseases: A Diagnostic Reference/ PABST, Dresden – 2011.
4. Conrad K, Schlosler W., Hiepe F., Fitzler M.J. Autoantibodies in Systemic Autoimmune Diseases: A Diagnostic Reference/ PABST, Dresden – 2007.
5. Gershvin ME, Meroni PL, Shoenfeld Y. Autoantibodies 2 nd ed./ Elsevier Science – 2006.
6. Shoenfeld Y., Cervera R, Gershvin ME Diagnostic Criteriain Autoimmune Diseases / Human Press – 2008.
Множественная миелома (миеломная болезнь)
Множественная миелома (миеломная болезнь)
Множественная миелома, миеломная болезнь, multiple myeloma.
При миеломной болезни появляются клинические проявления, которые объясняются пролиферацией миеломных клеток в костном мозге и действием продуцируемых ими иммуноглобулинов и свободных легких цепей. В результате вытеснения здорового костного мозга наблюдается угнетение нормального гемопоэза, что проявляется повышенной утомляемостью, объясняемой анемией, расстройством гемостаза из-за тромбоцитопении, рецидивами инфекции в результате гипогаммаглобулинемии или лейкопении. Пролиферация миеломных клеток и активность остеокластов приводят к гиперкальциемии, появлению «штампованных» дефектов костей и патологических переломов. Отложение моноклонального иммуноглобулина или свободных легких цепей оказывает прямое повреждение почек, приводя или к тубулярному, или гломерулярному повреждению (цилиндровой нефропатии или болезни отложения легких цепей соответственно), или к инфильтрации различных органов (сердца, печени, тонкой кишки, нервов), как в случае системного AL-амилоидоза. Синдром гипервязкости крови чаще развивается при повышенном IgA или IgM моноклональном иммуноглобулине (парапротеине) и может проявляться церебро-васкулярной или дыхательной недостаточностью. Повышенная скорость оседания эритроцитов может рассматриваться как маркер моноклональной гипергаммаглобулинемии и как нередкий повод для обследования пожилых больных.
Классификация множественной миеломы 2014 года
Обновленные критерии позволяют обеспечить раннюю диагностику и назначение лечения до развития поражения конечных органов. Как следует из критериев, диагноз миеломной болезни требует наличия 10% и более плазматических клеток при исследовании костного мозга или наличия плазмацитомы, доказанной биопсией, плюс одно или более нарушений, обусловленных заболеванием.
Диагностические критерии Международной рабочей группы для миеломной болезни и связанных клеточных нарушений (2014)
Наиболее характерно для миеломы обнаружение тубулоинтестинального повреждения почек, известного как цилиндровая нефропатия, которая является прямым следствием повышенного содержания свободных легких цепей иммуноглобулинов в крови. Клетки канальцевого эпителия повреждаются и атрофируются из-за усиленного «переноса» свободных цепей из просвета канальцев в интерстиций. На фоне обезвоживания может развиться синдром острой почечной недостаточности, обусловленный нарушением кровотока и канальциевыми нарушениями.
Наличие легких цепей в моче при миеломной болензи может вызвать нарушение функции почек, известное как вторичный синдром Фанкони. Он обусловлен недостаточностью реабсорбционной способности проксимальных канальцев, что проявляется глюкозурией, аминоацидурией, гипофосфатемией и гипоурикемией.
Свободные легкие цепи имеют высокую чувствительность и специфичность по сравнению с электрофорезом белков в моче. Больные с почечной недостаточностью при ММ имеют повышенное каппа/лямбда отношение даже при отсутствии доказательств моноклональной гаммапатии. Причина состоит в нарушении выделения легких цепей. У здоровых людей очищение крови от легких цепей осуществляется почками. Каппа цепи являются мономерными и быстрее покидают кровь сравнительно с лямбда цепями, что доказывается каппа/лямбда отношением в среднем 0.6 у лиц без поражения почек. У больных с почечной недостаточностью основной системой очищения становится ретикуло-эндотелиальная система, полупериод жизни каппа цепей из-за этого удлиняется. Отношение каппа/лямбда оказывается при почечной недостаточности равным в среднем 1.8. Свободные легкие цепи имеют высокую чувствительность и специфичность, и больные с почечной недостаточностью имеют повышенное каппа/лямбда отношение вследствие нарушения клиренса каппа и лямбда цепей.
Инфекционные осложнения при множественной миеломе.
При миеломной болезни возрастает частота бактериальных и вирусных инфекций в 7-10 раз по сравнению с популяционным контролем. Гемофильная палочка, пневмонический стрептококк, кишечная палочка, грам-отрицательные бактерии и вирусы (грипп и герпес зостер) являются наиболее частыми виновниками инфекции у больных миеломной болезнью.
Повышенная чувствительность больных к инфекционным заболеваниям является результатом двух основных обстоятельств. Во-первых, влиянием самого заболевания, во-вторых, пожилым возрастом и побочным действием проводимой терапии. Лимфоцитопения, гипогаммаглобулинемия, нейтропения вследствие инфильтрации миеломными клетками костного мозга и под влиянием проводимой химиотерапии обуславливают повышенную чувствительность к инфекции. Связанная с болезнью недостаточность врожденного иммунитета вовлекает разные части иммунной системы и включает дисфункцию В-клеток, а также функциональные отклонения со стороны дендритных клеток, Т- клеток и натуральных киллеров (NK). Нарушения функции почек и легких, слизистой ЖКТ, мультиорганные нарушения, вызванные отложением легких цепей иммуноглобулинов, также увеличивают риск инфекционных заболеваний. Наконец, миеломная болезнь поражает преимущественно пожилых лиц с коморбидными возрастными заболеваниями и малоподвижным образом жизни, исходно предрасположенных к инфекциям.
Иммуномодуляторы и глюкокортикоиды являются частью лечения наиболее тяжелых вариантов заболевания. При имеющихся инфекционных контактах, наличии нейтропении и гипогаммаглобулинемии и подавленном клеточном иммунитете терапия иммуномодуляторами требует профилактического назначения антибиотиков.
Гиперкальциемия
Признаки гиперкальциемии зависят от уровня кальция и быстроты его повышения, что создает необходимость в ускоренном обследовании. Большинство причин гиперкальциемии на практике обусловлено повышенным уровнем паратгормона и его производных (гуморальная форма), а в 20 % — с инфильтрацией костного мозга клетками опухолей (инфильтративная форма). Множественная миелома с легкими цепями в крови является самой частой причиной среди заболеваний крови. Число больных с гиперкальциемий из-за наличия опухоли в 2-3 раза выше, чем из-за первичного гиперпаратиреоза.
Для миеломной болезни с гиперкальциемией характерен низкий уровень паратгормона, фосфор находится в норме. При гуморальной форме гиперкальциемии обнаруживается повышенный уровень паратгормона, низкий уровень фосфора.
Тромбофилии
Риск венозных тромбозов обусловлен целым рядом причин, а миеломная болезнь его значительно увеличивает. К факторам риска тромбозов относятся пожилой возраст,, ограничение подвижности из-за болей, частые инфекции, дегидратация, почечная недостаточность, ожирение, сахарный диабет и другие коморбидные заболевания.
Среди проявлений наиболее опасна тромбоэмболия легких, которая может оказаться фатальной.
Частота примерно тромбоэмболии при миеломе оценивается в 5-8/100 больных.
Это связано с тем, что миелома сопровождается повышенной вязкостью крови, угнетением выработки естественных антикоагулянтов и гиперкоагуляцией крови, спровоцированной инфекциями, с повышенным уровнем фактора Виллебранда, фибриногена и фактора VIII, пониженным уровнем протеина S и так далее. Проведение курса лекарственной терапии, в том числе назначение эритропоэтинов, также может сыграть роль триггера венозных тромбоэмболий. Поэтому в первые месяцы терапии рекомендуется дополнять традиционную терапию миеломы аспирином или антикоагулянтной терапией.
Скрининг предрасположенности к тромбозам и венозной тромбоэмболии при миеломной болезни, наряду со стандартным коагулогическим обследованием, должен включать исследование вязкости крови.
Прогнозировование и факторы риска при миеломе
«Международная система прогнозирования» (ISS. 2005) была разработана на основании данных естественного исхода заболевания значительной клинической группы больных и основана на исследовании бета-2 микроглобулина в динамике. Бета-2 микроглобулин повышен у 75% больных миеломной болезнью.
Выделено три уровня этого онкомаркера, которые связаны с длительной выживаемостью пациентов. Это позволяет определить несколько стадий заболевния.
Однако, в настоящее время использование новых препаратов значительно изменило прогноз естественного течения заболевания. Тем не менее, международная система была протестирована для новейшей терапии и подтвердила свою надежность. Так, 5-летняя выживаемость больных в стадии I, II и III составила 66%, 45% и 18% соответственно.
В Международной системе не оказалось места для таких ценных прогностических показателей как число тромбоцитов, уровень лактатдегидрогеназы и свободных легких цепей в крови.
Число тромбоцитов в крови коррелирует с вытеснением костного мозга и имеет предсказательное значение выше, чем у альбумина. Содержание лактатдегидрогеназы (ЛДГ) коррелирует с общей массой миеломных клеток, недостаточным ответом на терапию и укорочением выживаемости. У больных с уровнем свободных легких цепей в крови свыше 4,75 г/л чаще выявляется почечная недостаточность, высокой процент миеломных клеток в пунктате костного мозга, высокие значения бета-2-микроглобулина и лактатдегдрогеназы, чаще обнаруживается болезнь отложения легких цепей и стадия III по Международной системе. Однако представленных доказательств оказалось недостаточно, чтобы включить эти три критерия в Международную систему. Но они были представлены в системе Дьюри-Саймона (1975), значение которой не оспаривается до сих пор.
Повышенный уровень сывороточного бета 2-микроглобулина, повышенный уровень лактатдегидрогеназы и низкий уровень сывороточного альбумина относятся к неблагоприятным признакам прогноза при миеломной болезни. Хотя уровень бета-2- микроглобулина увеличивается при почечной недостаточности, существует значительная корреляция между объемом опухолевой ткани и концентрацией этого биомаркера в крови. Исключение составляют лишь случаи, когда миеломная болезнь развивается уже на фоне имеющейся почечной недостаточности.
Перспективным методом оценки прогноза заболевания является генетическое исследование опухоль-ассоциированных генов. Цитогенетическое выявление транслокаций в отличие от трисомии относится к неблагоприятным прогностическим признакам. Метод флюоресцентной гибридизации in situ (FISH) позволил упростить выявление хромосомных аберраций в миеломных клетках, что предлагается исследователями клинико Мэйо (США) использовать для выбора индивидуальной лечебной тактики, исходя из прогноза для больного на основании учета выявленных аберраций. Генетические исследования хромосомных аномалий и мутаций при миеломе являются перспективными методами для лабораторной оценке прогноза и устойчивости к терапии при миеломе. Однако для их оценки требуются большие сроки и число пролеченных больных, чтобы определить способность новых средств терапии преодолеть цитогенетические показатели высокого риска при миеломной болезни.